задача здесь
суббота, 12 декабря 2015 г.
четверг, 3 декабря 2015 г.
Серная кислота 9 класс
Рассмотрим особенности взаимодействия с металлами концентрированной серной кислоты. Серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода, не образуя при этом водород.
В результате реакций концентрированной серной кислоты с металлами образуются соль, вода и продукты восстановления сульфат анионов:
- смесь этих продуктов + соль + вода
С неактивными металлами - сернистый газ + соль + вода
На холоду: пассивируются Fe, AL, Cr
При нагревании: все, кроме, Au, Pt
Концентрированная серная кислота - сильный окислитель
понедельник, 30 ноября 2015 г.
четверг, 26 ноября 2015 г.
среда, 25 ноября 2015 г.
Воздух 8 класс
Нас ждет очень интересная тема урока "Состав воздуха". Такое банальное словосочетание, а сколько за ним исследований, непредсказуемых открытий и торжества науки. Великие химики, уже знакомые нам по работам с кислородом, Д.Пристли и А.Лавуазье, были первыми и здесь. После долгих лабораторных исследований Антуан Лавуазье установил, что в состав воздуха входят два газа - азот и кислород. Кстати, именно Лавуазье предложил термин азот, что в переводе означает "безжизненный". Азот - химически неактивный газ, проявляет себя только при температурах свыше 2000 С или в других особых условиях. Это хорошо? ЗАМЕЧАТЕЛЬНО! Почему?
Содержание углекислого газа в воздухе - 0,03 %, это хорошо? А давайте увеличим....немножко. Нас ждет ....... эффект
воздух
Publish at Calameo or read more publications.
Жду ваших комментариев!
Интересные опыты с ртутью здесь
Интересные опыты с ртутью здесь
понедельник, 16 ноября 2015 г.
четверг, 22 октября 2015 г.
Моль, молярная масса 8 класс
В химии, как и в физике, существует раздел, изучающий количественные отношения реагирующих веществ, проще говоря, материал, позволяющий нам производить расчеты по химическим формулам и уравнениям.
Самые главные величины - это молярная масса, масса вещества, моль, молярный объем.
Информация о моле, как основной расчетной величине здесь
Тест 1
"Взаимосвязь между числом Авогадро, количеством вещества" здесь
Тест 2
"Взаимосвязь между массой вещества, количеством вещества и молярной массой" здесь
тест 3 здесь
тест 4 здесь
тест 5 здесь
тест 6 здесь
Самые главные величины - это молярная масса, масса вещества, моль, молярный объем.
Информация о моле, как основной расчетной величине здесь
Тест 1
"Взаимосвязь между числом Авогадро, количеством вещества" здесь
Тест 2
"Взаимосвязь между массой вещества, количеством вещества и молярной массой" здесь
тест 3 здесь
тест 4 здесь
тест 5 здесь
тест 6 здесь
Количественные отношения в химии, моль, молярная масса
Химия - это наука о веществах.Для измерения вещества была выбрана особая единица, в которой соединилось число молекул и масса вещества. Эта единица названа моль.
Экспериментально установлено, что 1 моль любого вещества всегда содержит одинаковое число молекул. Это число равно 6*1023. В честь итальянского ученого Амедео Авогадро это число назвали постоянной Авогадро. Обозначается оно NА. Масса 1 моль вещества называется молярной массой и обозначается буквой М.
 Граф Лоренцо Романо Амедео Карло Авогадро родился 9 августа 1776 года в Турине (Италия) в семье служащего судебного ведомства Филиппо Авогадро. Амедео был третьим из восьми детей. В юношеские годы посещал школу геометрии и экспериментальной физики. По традиции того времени профессии и должности передавались по наследству, поэтому Амедео занялся юриспруденцией. В 20 лет получил степень доктора церковного законоведения. В 25 лет начал самостоятельно изучать физико-математические науки.
Граф Лоренцо Романо Амедео Карло Авогадро родился 9 августа 1776 года в Турине (Италия) в семье служащего судебного ведомства Филиппо Авогадро. Амедео был третьим из восьми детей. В юношеские годы посещал школу геометрии и экспериментальной физики. По традиции того времени профессии и должности передавались по наследству, поэтому Амедео занялся юриспруденцией. В 20 лет получил степень доктора церковного законоведения. В 25 лет начал самостоятельно изучать физико-математические науки.
Экспериментально установлено, что 1 моль любого вещества всегда содержит одинаковое число молекул. Это число равно 6*1023. В честь итальянского ученого Амедео Авогадро это число назвали постоянной Авогадро. Обозначается оно NА. Масса 1 моль вещества называется молярной массой и обозначается буквой М.
 Граф Лоренцо Романо Амедео Карло Авогадро родился 9 августа 1776 года в Турине (Италия) в семье служащего судебного ведомства Филиппо Авогадро. Амедео был третьим из восьми детей. В юношеские годы посещал школу геометрии и экспериментальной физики. По традиции того времени профессии и должности передавались по наследству, поэтому Амедео занялся юриспруденцией. В 20 лет получил степень доктора церковного законоведения. В 25 лет начал самостоятельно изучать физико-математические науки.
Граф Лоренцо Романо Амедео Карло Авогадро родился 9 августа 1776 года в Турине (Италия) в семье служащего судебного ведомства Филиппо Авогадро. Амедео был третьим из восьми детей. В юношеские годы посещал школу геометрии и экспериментальной физики. По традиции того времени профессии и должности передавались по наследству, поэтому Амедео занялся юриспруденцией. В 20 лет получил степень доктора церковного законоведения. В 25 лет начал самостоятельно изучать физико-математические науки.
В 1803 и 1804 годах он, совместно со своим братом Феличе, представил в Туринскую академию наук две работы, посвященные теории электрических и электромагнитных явлений, за что и был избран в 1804 году членом-корреспондентом этой академии. В первой работе под названием «Аналитическая заметка об электричестве» он объяснил поведение проводников и диэлектриков в электрическом поле, в частности явление поляризации диэлектриков. Высказанные им идеи получили затем более полное развитие в работах других ученых. В 1806 году Авогадро получает место репетитора в Туринском лицее. В 1809 переводится преподавателем физики и математики в лицей города Варчелли.
В сентябре 1819 года Авогадро избирается членом Туринской академии наук. В 1820 году королевским указом Авогадро назначается первым профессором новой кафедры высшей физики в Туринский университет. В 1822 году Туринский университет был закрыт властями после студенческих волнений. В 1823 году Авогадро получает почетный титул заслуженного профессора высшей физики и назначается старшим инспектором в палату по контролю за государственными расходами. Несмотря на новые обязанности, Авогадро продолжал заниматься научными исследованиями.
В 1832 году Туринский университет вновь получил кафедру высшей физики, но ее предложили не Авогадро, а известному французскому математику Огюстену Луи Коши, покинувшему родину в 1830 году. Только спустя два года, после отъезда Коши, Авогадро смог занять эту кафедру, где и проработал до 1850 года. В этом году он ушел из университета, передав кафедру своему ученику Феличе Кью. После ухода из университета Авогадро некоторое время занимал должность старшего инспектора Контрольной палаты, а также состоял членом Высшей статистической комиссии, Высшего совета народного образования и председателем Комиссии мер и весов. Несмотря на почтенный возраст, он продолжал публиковать свои исследования в трудах Туринской академии наук. Последняя его работа вышла из печати за три года до смерти, когда Авогадро исполнилось 77 лет. Он умер в Турине 9 июля 1866 года и похоронен в семейном склепе в Верчелли.
пятница, 16 октября 2015 г.
Явления физические и химические 8 класс
Явления можно разделить на физические и химические.
При физических явлениях происходит изменение только агрегатного состояния вещества. Например, плавление стекла, испарение или замерзание воды.
При химических явлениях происходит превращение одних веществ в другие. Иначе химические явления называют химическими реакциями.
Признаки химических реакций - это:
1.образование осадка;
2.изменение цвета;
3.выделение газа;
4.появление запаха;
5.выделение теплоты.
Информация о признаках химических реакций здесь и здесь

вторник, 13 октября 2015 г.
среда, 30 сентября 2015 г.
Типы химических реакций 8 класс
Химические реакции можно разделить на четыре основных типа:
разложения, соединения,замещения, обмена.
Реакции соединения
Определение реакции соединения здесь, а тестовое задание здесь
Реакции разложения
Определение реакции разложения здесь , а тестовое задание здесь
Реакции замещения
Определение реакции замещения здесь, а тестовое задание здесь
Реакции обмена
Определение реакции обмена здесь, а тестовое задание здесь

разложения, соединения,замещения, обмена.
Реакции соединения
Определение реакции соединения здесь, а тестовое задание здесь
Реакции разложения
Определение реакции разложения здесь , а тестовое задание здесь
Реакции замещения
Определение реакции замещения здесь, а тестовое задание здесь
Реакции обмена
Определение реакции обмена здесь, а тестовое задание здесь

пятница, 25 сентября 2015 г.
Химические уравнения 8 класс
Закон сохранения массы веществ, открытый М.В. Ломоносовым в 1756 г., гласит
"Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции".
Подробнее можно посмотреть здесь
На основании этого закона составляются химические уравнения.Информация здесь
Расстановка коэффициентов в уравнении - тесты здесь, выполняем в тетради и проверяем на блоге.
В химическом уравнении количество атомов химического элемента в левой части должно быть равно количеству элементов в правой части. Как уравнять? Конечно, при помощи коэффициентов. Тогда уравнение реакции считается законченным.
А какие уравнения подходят под эту категорию? Это здесь . Выберите уравнения и аргументируйте свой ответ.
Успехов!

"Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции".
Подробнее можно посмотреть здесь
На основании этого закона составляются химические уравнения.Информация здесь
Расстановка коэффициентов в уравнении - тесты здесь, выполняем в тетради и проверяем на блоге.
В химическом уравнении количество атомов химического элемента в левой части должно быть равно количеству элементов в правой части. Как уравнять? Конечно, при помощи коэффициентов. Тогда уравнение реакции считается законченным.
А какие уравнения подходят под эту категорию? Это здесь . Выберите уравнения и аргументируйте свой ответ.
Успехов!

Тест "Валентность" 8 класс
Результаты теста будут предоставлены, посмотрите доступ в своей электронной почте. Красным цветом отмечены ошибки.
среда, 23 сентября 2015 г.
суббота, 19 сентября 2015 г.
валентность 8 класс
Мы говорили с вами о том, что химическая формула отображает состав вещества при помощи химических знаков и индексов. Рассмотрим формулы веществ, в состав которых входит химический элемент водород, HCL H2O NH3 CH4.
Почему количество атомов водорода разное?
Это можно объяснить только валентностью химических элементов.
I II I III
Н O Na Fe
Валентность бывает постоянной и переменной.
У кислорода - всегда II, у серы - II, IV, VI.
Почему количество атомов водорода разное?
Это можно объяснить только валентностью химических элементов.
Валентность - это способность химического элементам присоединять к себе определенное количество атомов других элементов.
Валентность обозначается римскими цифрами и ставится над элементом.I II I III
Н O Na Fe
Валентность бывает постоянной и переменной.
У кислорода - всегда II, у серы - II, IV, VI.
Валентность химических элементов
постоянная
I H Na K Li
II O Mg Ca Ba Zn
III Al B
Чтобы составить формулу по валентности, необходимо соблюдать следующий порядок действий:
1.написать знаки химических элементов
AL O
2.проставить над ними валентность
III II
AL O
3. найти наименьшее общее кратное (НОК) - в данном случае - 6
4. разделить НОК на валентность каждого элемента и проставить индексы
6
6
III II
AL2 O3
И еще, если валентность химических элементов одинакова, то формула остается без изменений.
Историю возникновения понятия "валентность" можно прочитать здесь.
Как составить формулу по валентности? Посмотрите ролик.
Историю возникновения понятия "валентность" можно прочитать здесь.
Как составить формулу по валентности? Посмотрите ролик.
пятница, 18 сентября 2015 г.
Атомная и молекулярная масса 8 класс
Размеры и массы молекул очень малы. Массы и размеры атомов еще меньше. Поэтому возникает вопрос:в каких единицах массы выражают массу атомов химических элементов?
Масса атома водорода 1,67375 * 10-24 г. Производить вычисления с такими маленькими величинами крайне неудобно.Ученые- химики схитрили, и для удобства массу атома химического элемента разделили на 1,66057 *10-24 г.
Полученные величины - это относительная атомная масса Аr (индекс r - от английского слова relative - относительный).
Относительные атомные массы изученных нами элементов запишем на уроке. Данные из таблицы химических элементов Д.И.Менделеева.
А если молекула простого или сложного вещества.? Тогда говорим об относительной молекулярной массе, Мr.
Для вычисления Мr необходимо суммировать относительные атомные массы элементов с учетом числа атомов (индекс). Посмотреть можно здесь
А поэтапно выполнить тесты здесь, посложнее здесь , и очень посидеть, и посчитать внимательно здесь
Успехов!

Масса атома водорода 1,67375 * 10-24 г. Производить вычисления с такими маленькими величинами крайне неудобно.Ученые- химики схитрили, и для удобства массу атома химического элемента разделили на 1,66057 *10-24 г.
Полученные величины - это относительная атомная масса Аr (индекс r - от английского слова relative - относительный).
Относительные атомные массы изученных нами элементов запишем на уроке. Данные из таблицы химических элементов Д.И.Менделеева.
А если молекула простого или сложного вещества.? Тогда говорим об относительной молекулярной массе, Мr.
Для вычисления Мr необходимо суммировать относительные атомные массы элементов с учетом числа атомов (индекс). Посмотреть можно здесь
А поэтапно выполнить тесты здесь, посложнее здесь , и очень посидеть, и посчитать внимательно здесь
Успехов!

среда, 16 сентября 2015 г.
Простые и сложные вещества 8А 8Б8 В классы
Из курса физики нам уже известно, что многие вещества состоят из молекул.
Молекулы (от латинск. "moles" масса)- это мельчайшие частицы, химически делимые. Молекулы состоят из атомов.
Атом- это мельчайшие химически неделимые частицы вещества.
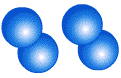
Молекула кислорода О2, состоит из двух атомов кислорода
простое вещество
 молекула озона О3, состоит из трех атомов кислорода
молекула озона О3, состоит из трех атомов кислорода
простое вещество

молекула воды Н2О состоит из двух атомов водорода и одного атома кислорода
сложное вещество
Если атомы одного вида соединяются вместе, то образуется простое вещество.
При взаимодействии атомов разных видов образуются сложные вещества.
Примеры сложных и простых веществ можно посмотреть здесь
А проверить свои знания нужно здесь
Успехов!
Молекулы (от латинск. "moles" масса)- это мельчайшие частицы, химически делимые. Молекулы состоят из атомов.
Атом- это мельчайшие химически неделимые частицы вещества.

Молекула кислорода О2, состоит из двух атомов кислорода
простое вещество
 молекула озона О3, состоит из трех атомов кислорода
молекула озона О3, состоит из трех атомов кислородапростое вещество

молекула воды Н2О состоит из двух атомов водорода и одного атома кислорода
сложное вещество
Если атомы одного вида соединяются вместе, то образуется простое вещество.
При взаимодействии атомов разных видов образуются сложные вещества.
Примеры сложных и простых веществ можно посмотреть здесь
А проверить свои знания нужно здесь
Успехов!
суббота, 5 сентября 2015 г.
Знаки химических элементов 8А, 8Б, 8В классам
Итак, для учащихся 8А, 8Б, 8В классов, первая информация и первое тестовое задание на блоге.
Для того, чтобы знать химию, необходимо изучить химический язык. Что это такое? Читаем здесь.
Спрашиваю, и сама отвечаю -это знаки химических элементов. Сколько химических элементов содержит современная периодическая система? Около 110 элементов. Многовато для первого знакомства, поэтому мы возьмем для изучения знаки 25 химических элементов.
В 1814г шведский химик Й.Я.Берцелиус ввел современное обозначение химических элементов.
Информация здесь
Для всех, не только для любознательных, обязательно читаем:
- астрономические названия химических элементов здесь
- географические названия химических элементов здесь
- названия химических элементов в честь ученых здесь
А здесь можно подсмотреть, хотя вся информация у вас в рабочей тетради.
Успехов!


пятница, 15 мая 2015 г.
Химическая связь 8 класс
Различают следующие виды химической связи: ковалентная неполярная, ковалентная полярная, ионная. Для определения вида связи используют понятие электроотрицательность (ЭО).
ЭО - это способность элемента оттягивать на себя электроны от атомов других элементов.
Таблица ЭО химических элементов находится на блоге в разделе таблицы по химии, посмотрите.
Образование ковалентной неполярной связи здесь.
Образование ковалентной полярной связи здесь.
Образование ионной связи здесь.
И, конечно, обязательно, на закрепление материала тест. Тест Маслову Е.
ЭО - это способность элемента оттягивать на себя электроны от атомов других элементов.
Таблица ЭО химических элементов находится на блоге в разделе таблицы по химии, посмотрите.
Образование ковалентной неполярной связи здесь.
Образование ковалентной полярной связи здесь.
Образование ионной связи здесь.
И, конечно, обязательно, на закрепление материала тест. Тест Маслову Е.
воскресенье, 26 апреля 2015 г.
Характеристика химического элемента 8 класс
Вот мы и заканчиваем с вами изучение Периодической системы Д.И.Менделеева, осталось несколько уроков и, конечно, небольшой зачет по пройденному материалу.
Тот, кто проболел, читайте все мои сообщения на блоге, подходите с вопросами.
Для помощи, выкладываю план характеристики химического элемента и проверочный тест.
1.Элемент
2.Период, ряд, группа, подгруппа
3.Заряд ядра, количество энергетических уровней, количество электронов
4.Количество протонов, электронов, нейтронов
5.Электронная формула, квантовые ячейки
6. S, P элемент
7.Валентность (количество электронов на последнем уровне)
8.Металл, неметалл
9.Формула высшего оксида, характер (основный, кислотный, амфотерный), какое основание или кислота соответствуют
10.Летучее водородное соединение
Интерактивные тесты
Характеристика металла по ПС здесь
Характеристика неметалла по ПС здесь

Тот, кто проболел, читайте все мои сообщения на блоге, подходите с вопросами.
Для помощи, выкладываю план характеристики химического элемента и проверочный тест.
1.Элемент
2.Период, ряд, группа, подгруппа
3.Заряд ядра, количество энергетических уровней, количество электронов
4.Количество протонов, электронов, нейтронов
5.Электронная формула, квантовые ячейки
6. S, P элемент
7.Валентность (количество электронов на последнем уровне)
8.Металл, неметалл
9.Формула высшего оксида, характер (основный, кислотный, амфотерный), какое основание или кислота соответствуют
10.Летучее водородное соединение
Интерактивные тесты
Характеристика металла по ПС здесь
Характеристика неметалла по ПС здесь
понедельник, 13 апреля 2015 г.
Состояние электронов в атоме 8 класс
Электроны в атомах могут находиться на различных расстояниях от ядра. Можно говорить лишь о вероятности пребывания электронов на определенном расстоянии. Область пребывания электронов в ядре называют орбиталью.
Орбитали бывают s p d f.
Материал этого урока всегда считался достаточно сложным и непонятным.
Последовательно, заглядывая в записи школьной тетради, выполняем тесты. Если что-то будет непонятно, напишите.
1. Уровни и подуровни здесь.
2.Электронные формулы атомов здесь.
3.Электронные формулы элементов ( 1,2 период) здесь
4.Электронные формулы элементов, интерактивный тест, здесь и здесь
Орбитали бывают s p d f.
Материал этого урока всегда считался достаточно сложным и непонятным.
Последовательно, заглядывая в записи школьной тетради, выполняем тесты. Если что-то будет непонятно, напишите.
1. Уровни и подуровни здесь.
2.Электронные формулы атомов здесь.
3.Электронные формулы элементов ( 1,2 период) здесь
4.Электронные формулы элементов, интерактивный тест, здесь и здесь
понедельник, 6 апреля 2015 г.
Периодическая система химических элементов 8 класс
Ребята, мы начали изучение очень важной темы "Периодическая система химических элементов". Чтобы лучше подготовиться к уроку, просмотрите и выполните интерактивные тесты:
Если вы все внимательно изучили и просмотрели интерактивные тесты, то легко справитесь с моим тестом. Комментарии, как всегда , желательны.

воскресенье, 5 апреля 2015 г.
Строение атома 8 класс
Информация о строении атома
1.Опыты Д.Томпсона здесь
2.Опыты Э.Резерфорда здесь
3.Основные характеристики элементарных частниц здесь (выполнить интерактивный тест)
4.Укажите количество протонов, электронов, нейтронов, тест здесь
5.Изотопы атома углерода, задание здесь
6.Относительный расчет атомной массы элемента здесь ( на примере атома хлора)
1.Опыты Д.Томпсона здесь
2.Опыты Э.Резерфорда здесь
3.Основные характеристики элементарных частниц здесь (выполнить интерактивный тест)
4.Укажите количество протонов, электронов, нейтронов, тест здесь
5.Изотопы атома углерода, задание здесь
6.Относительный расчет атомной массы элемента здесь ( на примере атома хлора)
атом
Publish at Calameo or read more publications.
среда, 21 января 2015 г.
вторник, 20 января 2015 г.
среда, 14 января 2015 г.
Основания 8 класс
Выполните тесты:
1. Классификация оснований по растворимости здесь
2.Свойства гидроксида натрия здесь
3.Оказание первой помощи при попадании на кожу здесь
4.Правила техники безопасности при работе со щелочами здесь
5.Составление названия оснований по формуле здесь
6.Составление формул оснований здесь
7.Соответствие: основание- оксида металла здесь
воскресенье, 11 января 2015 г.
Классификация оксидов 8 класс
Мы начинаем знакомиться с четырьмя важнейшими классами неорганических соединений: оксидами, основаниями, кислотами и солями.
С составом и определением оксидов мы уже знакомы, классификацию оксидов разобрали на предыдущем уроке. Презентация вам в помощь.
оксиды классификация
Publish at Calameo or read more publications.
Проверьте свои знания на тренажере.
Подписаться на:
Сообщения (Atom)
























