понедельник, 8 декабря 2014 г.
суббота, 6 декабря 2014 г.
Азот 9 класс
Publish at Calameo or read more publications.
Подгруппа азота N P As Sb Bi
Информация об азоте, как о химическом элементе здесь.
Удивительные свойства азота
среда, 3 декабря 2014 г.
воскресенье, 23 ноября 2014 г.
понедельник, 17 ноября 2014 г.
озон 8 класс
Publish at Calameo or read more publications.
Ребята! Жду ваших комментариев по поводу озона))) Интересна ли для вас была эта дополнительная информация? Или вы уже были с ней знакомы?
Для лучшей подготовки к самостоятельной работе по оксидам интерактивный тест
Воздух 8 класс
Нас ждет очень интересная тема урока "Состав воздуха". Такое банальное словосочетание, а сколько за ним исследований, непредсказуемых открытий и торжества науки. Великие химики, уже знакомые нам по работам с кислородом, Д.Пристли и А.Лавуазье, были первыми и здесь. После долгих лабораторных исследований Антуан Лавуазье установил, что в состав воздуха входят два газа - азот и кислород. Кстати, именно Лавуазье предложил термин азот, что в переводе означает "безжизненный". Азот - химически неактивный газ, проявляет себя только при температурах свыше 2000 С или в других особых условиях. Это хорошо? ЗАМЕЧАТЕЛЬНО! Почему?
Содержание углекислого газа в воздухе - 0,03 %, это хорошо? А давайте увеличим....немножко. Нас ждет ....... эффект
воздух
Publish at Calameo or read more publications.
Жду ваших комментариев!
Интересные опыты с ртутью здесь
Интересные опыты с ртутью здесь
вторник, 21 октября 2014 г.
Моль, молярная масса, молярный объем 8 класс
В химии, как и в физике, существует раздел, изучающий количественные отношения реагирующих веществ, проще говоря, материал, позволяющий нам производить расчеты по химическим формулам и уравнениям.
Самые главные величины - это молярная масса, масса вещества, моль, молярный объем.
Тест 1
"Взаимосвязь между числом Авогадро, количеством вещества" здесь
Тест 2
"Взаимосвязь между массой вещества, количеством вещества и молярной массой" здесь
тест 3 здесь
тест 4 здесь
тест 5 здесь
тест 6 здесь
Самые главные величины - это молярная масса, масса вещества, моль, молярный объем.
Тест 1
"Взаимосвязь между числом Авогадро, количеством вещества" здесь
Тест 2
"Взаимосвязь между массой вещества, количеством вещества и молярной массой" здесь
тест 3 здесь
тест 4 здесь
тест 5 здесь
тест 6 здесь
Количественные отношения, молярная масса, моль
Химия - это наука о веществах.Для измерения вещества была выбрана особая единица, в которой соединилось число молекул и масса вещества. Эта единица названа моль.
Экспериментально установлено, что 1 моль любого вещества всегда содержит одинаковое число молекул. Это число равно 6*1023. В честь итальянского ученого Амедео Авогадро это число назвали постоянной Авогадро. Обозначается оно NА. Масса 1 моль вещества называется молярной массой и обозначается буквой М.
 Граф Лоренцо Романо Амедео Карло Авогадро родился 9 августа 1776 года в Турине (Италия) в семье служащего судебного ведомства Филиппо Авогадро. Амедео был третьим из восьми детей. В юношеские годы посещал школу геометрии и экспериментальной физики. По традиции того времени профессии и должности передавались по наследству, поэтому Амедео занялся юриспруденцией. В 20 лет получил степень доктора церковного законоведения. В 25 лет начал самостоятельно изучать физико-математические науки.
Граф Лоренцо Романо Амедео Карло Авогадро родился 9 августа 1776 года в Турине (Италия) в семье служащего судебного ведомства Филиппо Авогадро. Амедео был третьим из восьми детей. В юношеские годы посещал школу геометрии и экспериментальной физики. По традиции того времени профессии и должности передавались по наследству, поэтому Амедео занялся юриспруденцией. В 20 лет получил степень доктора церковного законоведения. В 25 лет начал самостоятельно изучать физико-математические науки.
Экспериментально установлено, что 1 моль любого вещества всегда содержит одинаковое число молекул. Это число равно 6*1023. В честь итальянского ученого Амедео Авогадро это число назвали постоянной Авогадро. Обозначается оно NА. Масса 1 моль вещества называется молярной массой и обозначается буквой М.
 Граф Лоренцо Романо Амедео Карло Авогадро родился 9 августа 1776 года в Турине (Италия) в семье служащего судебного ведомства Филиппо Авогадро. Амедео был третьим из восьми детей. В юношеские годы посещал школу геометрии и экспериментальной физики. По традиции того времени профессии и должности передавались по наследству, поэтому Амедео занялся юриспруденцией. В 20 лет получил степень доктора церковного законоведения. В 25 лет начал самостоятельно изучать физико-математические науки.
Граф Лоренцо Романо Амедео Карло Авогадро родился 9 августа 1776 года в Турине (Италия) в семье служащего судебного ведомства Филиппо Авогадро. Амедео был третьим из восьми детей. В юношеские годы посещал школу геометрии и экспериментальной физики. По традиции того времени профессии и должности передавались по наследству, поэтому Амедео занялся юриспруденцией. В 20 лет получил степень доктора церковного законоведения. В 25 лет начал самостоятельно изучать физико-математические науки.
В 1803 и 1804 годах он, совместно со своим братом Феличе, представил в Туринскую академию наук две работы, посвященные теории электрических и электромагнитных явлений, за что и был избран в 1804 году членом-корреспондентом этой академии. В первой работе под названием «Аналитическая заметка об электричестве» он объяснил поведение проводников и диэлектриков в электрическом поле, в частности явление поляризации диэлектриков. Высказанные им идеи получили затем более полное развитие в работах других ученых. В 1806 году Авогадро получает место репетитора в Туринском лицее. В 1809 переводится преподавателем физики и математики в лицей города Варчелли.
В сентябре 1819 года Авогадро избирается членом Туринской академии наук. В 1820 году королевским указом Авогадро назначается первым профессором новой кафедры высшей физики в Туринский университет. В 1822 году Туринский университет был закрыт властями после студенческих волнений. В 1823 году Авогадро получает почетный титул заслуженного профессора высшей физики и назначается старшим инспектором в палату по контролю за государственными расходами. Несмотря на новые обязанности, Авогадро продолжал заниматься научными исследованиями.
В 1832 году Туринский университет вновь получил кафедру высшей физики, но ее предложили не Авогадро, а известному французскому математику Огюстену Луи Коши, покинувшему родину в 1830 году. Только спустя два года, после отъезда Коши, Авогадро смог занять эту кафедру, где и проработал до 1850 года. В этом году он ушел из университета, передав кафедру своему ученику Феличе Кью. После ухода из университета Авогадро некоторое время занимал должность старшего инспектора Контрольной палаты, а также состоял членом Высшей статистической комиссии, Высшего совета народного образования и председателем Комиссии мер и весов. Несмотря на почтенный возраст, он продолжал публиковать свои исследования в трудах Туринской академии наук. Последняя его работа вышла из печати за три года до смерти, когда Авогадро исполнилось 77 лет. Он умер в Турине 9 июля 1866 года и похоронен в семейном склепе в Верчелли.
вторник, 7 октября 2014 г.
Окислительно-восстановительные реакции 9 класс
Реакции, протекающие с изменением степени окисления, называются окислительно-восстановительными.
Степень окисления (СО) - это условный заряд, который приобретает атом, если он отдает или присоединяет электроны.
всю презентацию можно посмотреть здесь
Восстановитель -
это химический элемент, который отдает электроны, и повышает СО.
Окислитель - это химический элемент, который забирает электроны и понижает СО.
Как составить электронный баланс?
Он очень удобен для подбора коэффициентов в уравнении реакции.
Информация здесь
Степень окисления (СО) - это условный заряд, который приобретает атом, если он отдает или присоединяет электроны.
всю презентацию можно посмотреть здесь
Восстановитель -
это химический элемент, который отдает электроны, и повышает СО.
Окислитель - это химический элемент, который забирает электроны и понижает СО.
Как составить электронный баланс?
Он очень удобен для подбора коэффициентов в уравнении реакции.
Информация здесь
среда, 1 октября 2014 г.
Типы химических реакций 8А 8Б классы
Химические реакции можно разделить на четыре основных типа:
разложения, соединения,замещения, обмена.
Реакции соединения
Определение реакции соединения здесь, а тестовое задание здесь
Реакции разложения
Определение реакции соединения здесь , а тестовое задание здесь
Реакции замещения
Определение реакции замещения здесь, а тестовое задание здесь
Реакции обмена
Определение реакции обмена здесь, а тестовое задание здесь
разложения, соединения,замещения, обмена.
Реакции соединения
Определение реакции соединения здесь, а тестовое задание здесь
Реакции разложения
Определение реакции соединения здесь , а тестовое задание здесь
Реакции замещения
Определение реакции замещения здесь, а тестовое задание здесь
Реакции обмена
Определение реакции обмена здесь, а тестовое задание здесь
среда, 24 сентября 2014 г.
Валентность, атомная и молекулярная массы 8А 8Б классы
Задание должно быть выполнено в рабочей тетради, результат перенесен в тест. Вариант - только тест - неприемлем. Возможность заполнить тест -до 21.00.
воскресенье, 21 сентября 2014 г.
Относительная атомная и молекулярная массы 8А 8 Б классы
Размеры и массы молекул очень малы. Массы и размеры атомов еще меньше. Поэтому возникает вопрос:в каких единицах массы выражают массу атомов химических элементов?
Масса атома водорода 1,67375 * 10-24 г. Производить вычисления с такими маленькими величинами крайне неудобно.Ученые- химики схитрили, и для удобства массу атома химического элемента разделили на 1,66057 *10-24 г.
Полученные величины - это относительная атомная масса Аr (индекс r - от английского слова relative - относительный).
Относительные атомные массы изученных нами элементов запишем на уроке. Данные из таблицы химических элементов Д.И.Менделеева.
А если молекула простого или сложного вещества.? Тогда говорим об относительной молекулярной массе, Мr.
Для вычисления Мr необходимо суммировать относительные атомные массы элементов с учетом числа атомов (индекс). Посмотреть можно здесь
А поэтапно выполнить тесты здесь, посложнее здесь , и очень посидеть, и посчитать внимательно здесь
Успехов!

Масса атома водорода 1,67375 * 10-24 г. Производить вычисления с такими маленькими величинами крайне неудобно.Ученые- химики схитрили, и для удобства массу атома химического элемента разделили на 1,66057 *10-24 г.
Полученные величины - это относительная атомная масса Аr (индекс r - от английского слова relative - относительный).
Относительные атомные массы изученных нами элементов запишем на уроке. Данные из таблицы химических элементов Д.И.Менделеева.
А если молекула простого или сложного вещества.? Тогда говорим об относительной молекулярной массе, Мr.
Для вычисления Мr необходимо суммировать относительные атомные массы элементов с учетом числа атомов (индекс). Посмотреть можно здесь
А поэтапно выполнить тесты здесь, посложнее здесь , и очень посидеть, и посчитать внимательно здесь
Успехов!

вторник, 16 сентября 2014 г.
Валентность 8А , 8Б классы
Мы говорили с вами о том, что химическая формула отображает состав вещества при помощи химических знаков и индексов. Рассмотрим формулы веществ, в состав которых входит химический элемент водород, HCL H2O NH3 CH4.
Почему количество атомов водорода разное?
Это можно объяснить только валентностью химических элементов.
I II I III
Н O Na Fe
Валентность бывает постоянной и переменной.
У кислорода - всегда II, у серы - II, IV, VI.
Почему количество атомов водорода разное?
Это можно объяснить только валентностью химических элементов.
Валентность - это способность химического элементам присоединять к себе определенное количество атомов других элементов.
Валентность обозначается римскими цифрами и ставится над элементом.I II I III
Н O Na Fe
Валентность бывает постоянной и переменной.
У кислорода - всегда II, у серы - II, IV, VI.
Валентность химических элементов
постоянная
I H Na K Li
II O Mg Ca Ba Zn
III Al B
Чтобы составить формулу по валентности, необходимо соблюдать следующий порядок действий:
1.написать знаки химических элементов
AL O
2.проставить над ними валентность
III II
AL O
3. найти наименьшее общее кратное (НОК) - в данном случае - 6
4. разделить НОК на валентность каждого элемента и проставить индексы
6
6
III II
AL2 O3
И еще, если валентность химических элементов одинакова, то формула остается без изменений.
воскресенье, 14 сентября 2014 г.
Атомы, молекулы. Простые и сложные вещества 8А , 8Б классы
Из курса физики нам уже известно, что многие вещества состоят из молекул.
Молекулы (от латинск. "moles" масса)- это мельчайшие частицы, химически делимые. Молекулы состоят из атомов.
Атом- это мельчайшие химически неделимые частицы вещества.
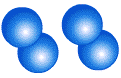
Молекула кислорода О2, состоит из двух атомов кислорода
простое вещество
 молекула озона О3, состоит из трех атомов кислорода
молекула озона О3, состоит из трех атомов кислорода
простое вещество
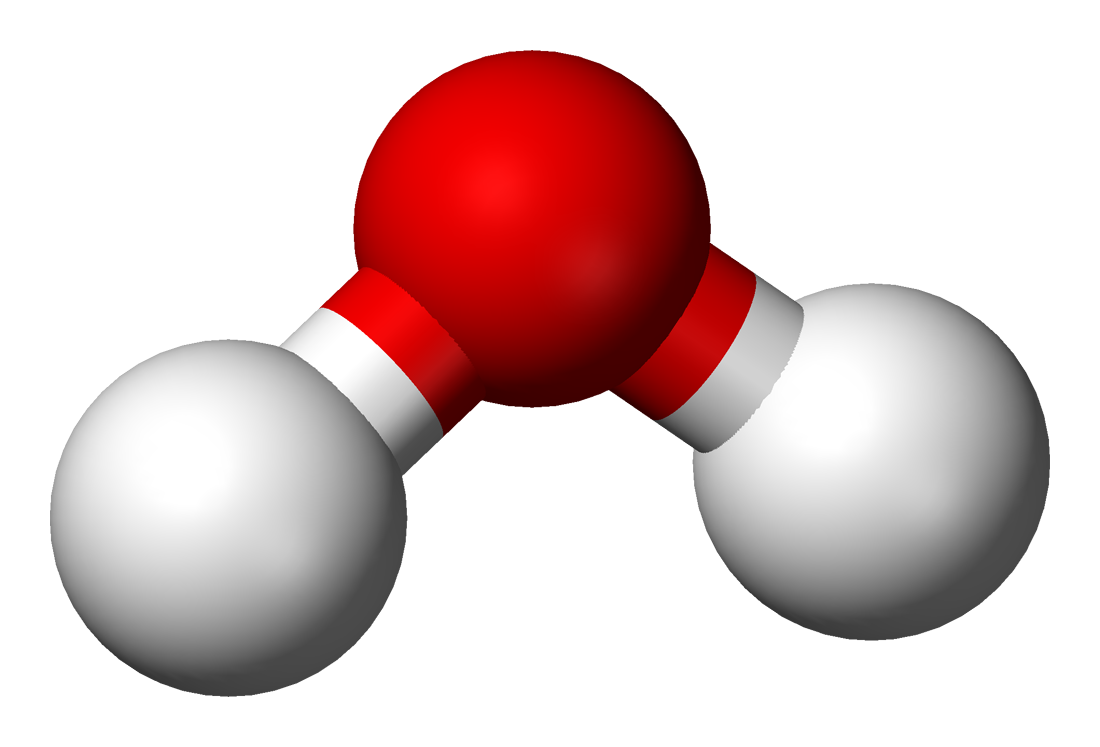
молекула воды Н2О состоит из двух атомов водорода и одного атома кислорода
сложное вещество
Если атомы одного вида соединяются вместе, то образуется простое вещество.
При взаимодействии атомов разных видов образуются сложные вещества.
Примеры сложных и простых веществ можно посмотреть здесь
А проверить свои знания нужно здесь
Успехов!
Молекулы (от латинск. "moles" масса)- это мельчайшие частицы, химически делимые. Молекулы состоят из атомов.
Атом- это мельчайшие химически неделимые частицы вещества.

Молекула кислорода О2, состоит из двух атомов кислорода
простое вещество
 молекула озона О3, состоит из трех атомов кислорода
молекула озона О3, состоит из трех атомов кислородапростое вещество

молекула воды Н2О состоит из двух атомов водорода и одного атома кислорода
сложное вещество
Если атомы одного вида соединяются вместе, то образуется простое вещество.
При взаимодействии атомов разных видов образуются сложные вещества.
Примеры сложных и простых веществ можно посмотреть здесь
А проверить свои знания нужно здесь
Успехов!
среда, 10 сентября 2014 г.
Химические формулы 8А 8Б классы
Итак, мы изучили с вами знаки химических элементов. Что дальше? Конечно же, химические формулы.
Привожу пример Р2О5, Н2О, MgO, AL2O3
Р2О5 - (читается пэ -два- о пять) два атома фосфора и пять атомов кислорода

Чтобы отразить число молекул используют коэффициент. Коэффициент пишется перед формулой и может означать число как молекул, так и атомов.
5 Р2О5- десять атомов фосфора, двадцать пять атомов кислорода, пять молекул
5 Р- пять атомов фосфора.
Для домашней работы - тест
ребята! я закрою тест в воскресенье в 22.00. В 22.10 в вашей почте вы получите доступ к ответам. Неправильные ответы я отмечу красным цветом.
Химические формулы - это условная запись состава вещества посредством химических знаков и индексов.
Индекс - цифра, стоящая справа внизу от символа, означает число атомов в молекуле
Привожу пример Р2О5, Н2О, MgO, AL2O3
Р2О5 - (читается пэ -два- о пять) два атома фосфора и пять атомов кислорода

Чтобы отразить число молекул используют коэффициент. Коэффициент пишется перед формулой и может означать число как молекул, так и атомов.
5 Р2О5- десять атомов фосфора, двадцать пять атомов кислорода, пять молекул
5 Р- пять атомов фосфора.
Для домашней работы - тест
ребята! я закрою тест в воскресенье в 22.00. В 22.10 в вашей почте вы получите доступ к ответам. Неправильные ответы я отмечу красным цветом.
пятница, 5 сентября 2014 г.
Диссоциация кислот, оснований, солей 9а 9б классы
Итак, на прошлом уроке мы выяснили, что к категории электролитов относятся кислоты, соли, основания
На какие ионы распадаются кислоты?
Предположу, что на ионы водорода и кислотного остатка. (проверим на опыте и уточним формулировку).
А чтобы еще раз вспомнить материал по классификации сложных веществ, пройдите интерактивные тесты:

На какие ионы распадаются кислоты?
Предположу, что на ионы водорода и кислотного остатка. (проверим на опыте и уточним формулировку).
А чтобы еще раз вспомнить материал по классификации сложных веществ, пройдите интерактивные тесты:

Электролитическая диссоциация 9а, 9б классы
Мы приступаем к изучению раздела "Электролитическая диссоциация"
Что происходит с веществами под воздействием молекул воды?
1.Электролиты и неэлектролиты.
Какие классы, раннее изученных нами веществ, мы можем отнести к этой категории?
Ответ здесь.
Сущность процесса электролитической диссоциации здесь
Основные положения теории электролитической диссоциации были разработаны шведским ученым, Нобелевским лауреатом Сванте Аррериусом в 1887 году. Ознакомиться с биографией ученого можно здесь.

Что происходит с веществами под воздействием молекул воды?
1.Электролиты и неэлектролиты.
Какие классы, раннее изученных нами веществ, мы можем отнести к этой категории?
Ответ здесь.
Сущность процесса электролитической диссоциации здесь
Основные положения теории электролитической диссоциации были разработаны шведским ученым, Нобелевским лауреатом Сванте Аррериусом в 1887 году. Ознакомиться с биографией ученого можно здесь.
четверг, 4 сентября 2014 г.
Химические знаки 8А и 8Б класс
Итак, для учащихся 8А и 8Б классов, первая информация и первое тестовое задание на блоге.
Для того, чтобы знать химию, необходимо изучить химический язык. Что это такое? Читаем здесь.
Спрашиваю, и сама отвечаю -это знаки химических элементов. Сколько химических элементов содержит современная периодическая система? Около 110 элементов. Многовато для первого знакомства, поэтому мы возьмем для изучения знаки 25 химических элементов.
В 1814г шведский химик Й.Я.Берцелиус ввел современное обозначение химических элементов.
Информация здесь
Для всех, не только для любознательных, обязательно читаем:
- астрономические названия химических элементов здесь
- географические названия химических элементов здесь
- названия химических элементов в честь ученых здесь
А здесь можно подсмотреть, хотя вся информация у вас в рабочей тетради.
Успехов!


вторник, 27 мая 2014 г.
закончился учебный год 8А 8Б
Ребята! мы прошагали с вами по планете "Химия" целый учебный год Это много или мало? Для вас, наверное много. Для меня это попытка научить вас полюбить такой замечательный предмет, как химия. Что удалось, и что не совсем получилось? Хотелось бы, чтобы вы оставили свои комментарии, особенно интересно, помогли ли вам электронные образовательные ресурсы (тесты, блог, объясняшки) в усвоении новых знаний. С удовольствием ли вы открывали свою рабочую тетрадь, чтобы выполнить домашнюю работу, а потом идти ко мне на урок.? С каким настроением вы выходили с урока химии? Вообщем, напишите свои мысли, чувства, пожелания. С нетерпением буду ждать!
Добавлю, что мне интересно было с вами работать, я с удовольствием готовилась у урокам и "стояла" у доски, искала новый материал для работы и тоже училась.
Хороших вам каникул! Ваша Галина Васильевна
Добавлю, что мне интересно было с вами работать, я с удовольствием готовилась у урокам и "стояла" у доски, искала новый материал для работы и тоже училась.
Хороших вам каникул! Ваша Галина Васильевна
вторник, 13 мая 2014 г.
Химическая связь 8 класс
Различают следующие виды химической связи: ковалентная неполярная, ковалентная полярная, ионная. Для определения вида связи используют понятие электроотрицательность (ЭО).
ЭО - это способность элемента оттягивать на себя электроны от атомов других элементов.
Таблица ЭО химических элементов находится на блоге в разделе таблицы по химии, посмотрите.
Образование ковалентной неполярной связи здесь.
Образование ковалентной полярной связи здесь.
Образование ионной связи здесь.
И, конечно, обязательно, на закрепление материала тест.
ЭО - это способность элемента оттягивать на себя электроны от атомов других элементов.
Таблица ЭО химических элементов находится на блоге в разделе таблицы по химии, посмотрите.
Образование ковалентной неполярной связи здесь.
Образование ковалентной полярной связи здесь.
Образование ионной связи здесь.
И, конечно, обязательно, на закрепление материала тест.
вторник, 22 апреля 2014 г.
Характеристика химического элемента 8 класс
Вот мы и заканчиваем с вами изучение Периодической системы Д.И.Менделеева, осталось несколько уроков и, конечно, небольшой зачет по пройденному материалу.
Для помощи, выкладываю план характеристики химического элемента и проверочный тест.
1.Элемент
2.Период, ряд, группа, подгруппа
3.Заряд ядра, количество энергетических уровней, количество электронов
4.Количество протонов, электронов, нейтронов
5.Электронная формула, квантовые ячейки
6. S, P элемент
7.Валентность (количество электронов на последнем уровне)
8.Металл, неметалл
9.Формула высшего оксида, характер (основный, кислотный, амфотерный), какое основание или кислота соответствуют
10.Летучее водородное соединение
Интерактивные тесты
Характеристика металла по ПС здесь
Характеристика неметалла по ПС здесь
Для помощи, выкладываю план характеристики химического элемента и проверочный тест.
1.Элемент
2.Период, ряд, группа, подгруппа
3.Заряд ядра, количество энергетических уровней, количество электронов
4.Количество протонов, электронов, нейтронов
5.Электронная формула, квантовые ячейки
6. S, P элемент
7.Валентность (количество электронов на последнем уровне)
8.Металл, неметалл
9.Формула высшего оксида, характер (основный, кислотный, амфотерный), какое основание или кислота соответствуют
10.Летучее водородное соединение
Интерактивные тесты
Характеристика металла по ПС здесь
Характеристика неметалла по ПС здесь
среда, 9 апреля 2014 г.
Состояние электронов в атоме 8 класс
Электроны в атомах могут находиться на различных расстояниях от ядра. Можно говорить лишь о вероятности пребывания электронов на определенном расстоянии. Область пребывания электронов в ядре называют орбиталью.
Орбитали бывают s p d f.
Материал этого урока всегда считался достаточно сложным и непонятным.
Последовательно, заглядывая в записи школьной тетради, выполняем тесты.
1. Уровни и подуровни здесь.
2.Электронные формулы атомов здесь.
3.Электронные формулы элементов ( 1,2 период) здесь
4.Электронные формулы элементов, интерактивный тест, здесь и здесь
Орбитали бывают s p d f.
Материал этого урока всегда считался достаточно сложным и непонятным.
Последовательно, заглядывая в записи школьной тетради, выполняем тесты.
1. Уровни и подуровни здесь.
2.Электронные формулы атомов здесь.
3.Электронные формулы элементов ( 1,2 период) здесь
4.Электронные формулы элементов, интерактивный тест, здесь и здесь
воскресенье, 6 апреля 2014 г.
Строение электронных оболочек 8 класс
Самые значимые выводы, которые мы сделали на уроке:
- N периода - это количество энергетических уровней,
- N группы - это количество электронов на последнем уровне у элементов главных подгрупп,
- завершенный уровень содержит 8 электронов на последнем уровне у элементов главных подгрупп (иск.1 уровень),
- незавершенный уровень - от 1 до 7 электронов на последнем уровне у элементов главных подгрупп.
четверг, 3 апреля 2014 г.
среда, 2 апреля 2014 г.
Создаем свои объясняшки
Запись в группы здесь
ребята, у кого есть айпады, загрузите из App Store программу "Объясняшки" и подойдите ко мне завтра на любой перемене.

ребята, у кого есть айпады, загрузите из App Store программу "Объясняшки" и подойдите ко мне завтра на любой перемене.
вторник, 1 апреля 2014 г.
Строение атома 8 класс
Информация о строении атома
1.Опыты Д.Томпсона здесь
2.Опыты Э.Резерфорда здесь
3.Основные характеристики элементарных частниц здесь (выполнить интерактивный тест)
4.Укажите количество протонов, электронов, нейтронов, тест здесь
5.Изотопы атома углерода, задание здесь
6.Относительный расчет атомной массы элемента здесь ( на примере атома хлора)
Задания в форме теста по этой теме не даю, вся информация была на уроке, ДЗ выполняем в классной тетради.
атом
Publish at Calameo or read more publications.
Оставьте свои комментарии!!!
1.Опыты Д.Томпсона здесь
2.Опыты Э.Резерфорда здесь
3.Основные характеристики элементарных частниц здесь (выполнить интерактивный тест)
4.Укажите количество протонов, электронов, нейтронов, тест здесь
5.Изотопы атома углерода, задание здесь
6.Относительный расчет атомной массы элемента здесь ( на примере атома хлора)
Задания в форме теста по этой теме не даю, вся информация была на уроке, ДЗ выполняем в классной тетради.
атом
Оставьте свои комментарии!!!
Периодическая система химических элементов 8 класс
Положение элемента в ПС смотри здесь
Структурные части ПС - периоды здесь, группы здесь
Интерактивные тесты "Положение элемента в ПС" здесь и здесь
Проверьте себя, судя по уроку, данная тема не вызвала у вас никаких затруднений.
И вам в помощь презентация урока.
Успехов! Завтра на уроке обсудим результат.
Структурные части ПС - периоды здесь, группы здесь
Интерактивные тесты "Положение элемента в ПС" здесь и здесь
Проверьте себя, судя по уроку, данная тема не вызвала у вас никаких затруднений.
И вам в помощь презентация урока.
Успехов! Завтра на уроке обсудим результат.
воскресенье, 30 марта 2014 г.
Объяснишки всем !
Незаметно пролетели весенние каникулы. Для меня эта неделя - неделя творчества, встреч с интересными людьми и, конечно, постижение чего то нового, креативного. Ведь уже пятый год подряд у нас в Санкт-Петербурге проходит международная конференция "Информационные технологии для Новой школы".
В этом году особенно запомнилась встреча и посещение мастер -класса Сергея Гевлича.
Делюсь с вами своими впечатлениями:
программа "Объяснишки", нужен айпад (я попросила у сына), он мне и программу установил ( программа платная 99 рублей, всего лишь). Посидела, разобралась и первый ролик готов, быстро, легко и понятно.
28 марта пятичасовое совместное занятие с коллегами ( и никаких переменок). Сергей рассказывал о методике создания роликов, и мы с увлечением включились в работу. Думала только о вас, мои дорогие зайчики и котики! Как здорово можно будет объяснять материал по химии!
Вот только рисовать у меня не совсем получилось, нужен специальный карандаш, хотя можно и "ручками". Как вам????
У нас в каждом классе найдется штук 5 айпадов, можно организовать работу в группах и вперед!
Во вторник встретимся и обсудим, а сегодня, завтра жду ваших комментариев.
В этом году особенно запомнилась встреча и посещение мастер -класса Сергея Гевлича.
Делюсь с вами своими впечатлениями:
программа "Объяснишки", нужен айпад (я попросила у сына), он мне и программу установил ( программа платная 99 рублей, всего лишь). Посидела, разобралась и первый ролик готов, быстро, легко и понятно.
28 марта пятичасовое совместное занятие с коллегами ( и никаких переменок). Сергей рассказывал о методике создания роликов, и мы с увлечением включились в работу. Думала только о вас, мои дорогие зайчики и котики! Как здорово можно будет объяснять материал по химии!
Вот только рисовать у меня не совсем получилось, нужен специальный карандаш, хотя можно и "ручками". Как вам????
У нас в каждом классе найдется штук 5 айпадов, можно организовать работу в группах и вперед!
Во вторник встретимся и обсудим, а сегодня, завтра жду ваших комментариев.
понедельник, 17 марта 2014 г.
Практическая работа 8 класс
Ребята, совершенно выпустила из виду - возьмите на урок, для проведения опытов ГВОЗДЬ
суббота, 15 марта 2014 г.
понедельник, 10 марта 2014 г.
Химические свойства кислот 8 класс
Химические свойства кислот:
1.Кислоты изменяют цвет индикаторов - лакмус краснеет, метиловый оранжевый становится розовым
2.С металлами, стоящими в ряду напряжений до водорода (исключение- азотная кислота и концентрированная серная)
Zn + 2HCL = ZnCL2 + H2
3.С основными оксидами, образуется соль и вода
CaO + H2SO4 = CaSO4 + H2O
4.С растворимыми и нерастворимыми основаниями, образуется соль и вода
NaOH + HCL = NaCL + H2O
5. С Солями. В соответствии с рядом кислот (каждая предыдущая кислота может вытеснить из соли последующую H2SO4 HCL HNO3 H3PO4 H2SO3 H2CO3 H2S H2SiO3)
Образуется соль и другая кислота.
Для самостоятельной работы задание здесь, выполняем в тетради.
понедельник, 3 марта 2014 г.
Классификация кислот 8 класс
Еще раз возвращаемся к теме "Кислоты". Определение кислот при помощи индикаторов можно посмотреть здесь.
Классификация кислот по водороду и кислороду, посмотри здесь.
А каким кислотным оксидам соответствуют определенные кислоты? Тест здесь.
А правила техники безопасности при работе с кислотами посмотреть всем обязательно!

Классификация кислот по водороду и кислороду, посмотри здесь.
А каким кислотным оксидам соответствуют определенные кислоты? Тест здесь.
А правила техники безопасности при работе с кислотами посмотреть всем обязательно!

Оценки за тесты 8а 8б
Ребята! Выставляю в журнал оценки за два последних теста. Даже, если вы пропустили эти уроки, тесты должны быть выполнены обязательно.
понедельник, 17 февраля 2014 г.
Тестирование. Программа INDIGO
Учащимся 8, 9 10 классов!
Ребята! У нас появилась возможность проводить тестирование, используя программу INDIGO. Вам необходимо зарегистрироваться, для этого пройдите по ссылке, которую вы получите по электронной почте и зарегистрируйтесь на сайте этой программы. Обязательно определите себя в свой класс. Сроки: с 18.02- 23.02.14.
Ребята! У нас появилась возможность проводить тестирование, используя программу INDIGO. Вам необходимо зарегистрироваться, для этого пройдите по ссылке, которую вы получите по электронной почте и зарегистрируйтесь на сайте этой программы. Обязательно определите себя в свой класс. Сроки: с 18.02- 23.02.14.
воскресенье, 16 февраля 2014 г.
Химические свойства оснований 8 класс
Основания - это сложные вещества, состоящие из атомов металла и гидроксогруппы. Количество гидроксогрупп равно валентности металла.
Основания делятся на растворимые в воде - щелочи и нерастворимые.
Растворы щелочей, мыльные на ощупь, меняют цвет индикаторов (лакмус, метиловый оранжевый, фенолфталеин).
Типичные реакции растворимых оснований (щелочей)
1. Основание + кислотный оксид = соль и вода
рассмотрена нами ранее, в теме "Кислотные оксиды"
2.Основание + кислота = соль и вода
Это реакция обмена (два сложных вещества обмениваются своими составными частями), частный случай - реакция нейтрализации.
3.Основание + соль = новое основание+ новая соль
Основания делятся на растворимые в воде - щелочи и нерастворимые.
Растворы щелочей, мыльные на ощупь, меняют цвет индикаторов (лакмус, метиловый оранжевый, фенолфталеин).
Типичные реакции растворимых оснований (щелочей)
1. Основание + кислотный оксид = соль и вода
рассмотрена нами ранее, в теме "Кислотные оксиды"
2.Основание + кислота = соль и вода
Это реакция обмена (два сложных вещества обмениваются своими составными частями), частный случай - реакция нейтрализации.
3.Основание + соль = новое основание+ новая соль
среда, 12 февраля 2014 г.
Задачи на примеси 9 класс
1.Какая масса азотной кислоты образуется при
взаимодействии серной кислоты с 200г
нитрата натрия, содержащего 10% примесей?
2.Какой объем газа выделится при разложении 300г
нитрата лития, содержащего 20% примесей?
3. Какая масса азотной кислоты образуется при
взаимодействии 196г серной кислоты и 100г нитрата калия, сод.20% примесей?
4.При разложении 250г нитрата натрия выделился
газ объемом 22,4л. Найдите долю чистого вещества нитрата натрия в исходном образце?
понедельник, 10 февраля 2014 г.
вторник, 4 февраля 2014 г.
Химические свойства основных и кислотных оксидов 8 класс
Выполним задание теста в тетради, а мне отправим только правильные ответы
Химические свойства кислотных оксидов 8 класс
Кислотные оксиды - это такие оксиды, которым соответствуют определенные кислоты, например, СО2, N2O5, SO3, CrO3
К кислотным оксидам относятся оксиды металлов с валентностью V - VII и оксиды неметаллов с валентностью III- VII.
Типичные реакции кислотных оксидов:
1.Кислотный оксид + вода = кислота (иск. SiO2)
2.Основной оксид + кислотный оксид = соль
3.Кислотный оксид + основание (Р,М) = соль и вода
Как записать уравнение химической реакции? Смотри здесь
Жду ваших комментариев, помогают ли вам при подготовке домашнего задания теоретические и практические пособия, размещенные на блоге?
Химические свойства основных оксидов 8 класс
Основные оксиды - это такие оксиды, которым соответствуют определенные основания, например, Na2O, MgO, K2O.
К основным оксидам относятся оксиды металлов с валентностью I и II. Все основные оксиды представляют собой твердые вещества.
Типичные реакции основных оксидов:
1. Основной оксид + кис лота = соль + вода
2.Основной оксид + кислотный оксид = соль
Как записать уравнение химической реакции? Смотри здесь
3.Основный оксид + вода = щелочь (эта реакция протекает только в случае, если образуется растворимое основание - щелочь , см. таблицу растворимости)
К основным оксидам относятся оксиды металлов с валентностью I и II. Все основные оксиды представляют собой твердые вещества.
Типичные реакции основных оксидов:
1. Основной оксид + кис лота = соль + вода
2.Основной оксид + кислотный оксид = соль
Как записать уравнение химической реакции? Смотри здесь
3.Основный оксид + вода = щелочь (эта реакция протекает только в случае, если образуется растворимое основание - щелочь , см. таблицу растворимости)
воскресенье, 2 февраля 2014 г.
Кислотные, основные, амфотерные оксиды 8 класс
Ребята, на последнем уроке, выяснилось, что задание на классификацию оксидов и их соответствие основаниям и кислотам вызвало затруднение. Выполните интерактивное задание "Соответствие основных оксидов и оснований", проверьте себя еще раз.
Смотри здесь
А здесь небольшая информация о гидроксиде натрия, обязательно посмотрите.
Желаю успеха!
Смотри здесь
А здесь небольшая информация о гидроксиде натрия, обязательно посмотрите.
Желаю успеха!
среда, 29 января 2014 г.
Классификация оксидов 8 класс
Мы начинаем знакомиться с четырьмя важнейшими классами неорганических соединений: оксидами, основаниями, кислотами и солями.
С составом и определением оксидов мы уже знакомы, классификацию оксидов разобрали на предыдущем уроке. Презентация вам в помощь.
Проверьте свои знания на тренажере.
С составом и определением оксидов мы уже знакомы, классификацию оксидов разобрали на предыдущем уроке. Презентация вам в помощь.
Проверьте свои знания на тренажере.
воскресенье, 26 января 2014 г.
Химические свойства воды 8 класс
Вода реагирует со многими веществами. В обобщенном виде приведем примеры важнейших химических реакций, в которых участвует вода.
1. Взаимодействие воды с металлами (см. ряд напряжений металлов)

а) активные металлы (Li- Al) + вода = гидроксид металла + водород
2Na + 2H2O = 2NaOH + H2 ( реакция идет при обычных условиях)
a) металлы средней активности (Zn - Pb) + вода = оксид металла + водород
Zn + H2O = ZnO + H2 (реакция идет при нагревании)
в) неактивные металлы ( Cu- Au) + вода = нет реакции
2. Взаимодействие воды с оксидами металлов (см. таблицу растворимости)

оксид металла + вода = гидроксид
( только те оксиды, которым соответствуют растворимые и малорастворимые основания)
3.Взаимодействие воды с оксидами неметаллов
оксид неметалла + вода = кислота (исключение - SiO2 формула речного песка)
Проверьте свои знания, выполнив тест
Кто не сделал ошибок? Напишите. Помог ли вам материал урока, размещенный на блоге?
1. Взаимодействие воды с металлами (см. ряд напряжений металлов)
а) активные металлы (Li- Al) + вода = гидроксид металла + водород
2Na + 2H2O = 2NaOH + H2 ( реакция идет при обычных условиях)
a) металлы средней активности (Zn - Pb) + вода = оксид металла + водород
Zn + H2O = ZnO + H2 (реакция идет при нагревании)
в) неактивные металлы ( Cu- Au) + вода = нет реакции
2. Взаимодействие воды с оксидами металлов (см. таблицу растворимости)

оксид металла + вода = гидроксид
( только те оксиды, которым соответствуют растворимые и малорастворимые основания)
3.Взаимодействие воды с оксидами неметаллов
оксид неметалла + вода = кислота (исключение - SiO2 формула речного песка)
Проверьте свои знания, выполнив тест
Кто не сделал ошибок? Напишите. Помог ли вам материал урока, размещенный на блоге?
пятница, 24 января 2014 г.
Вода 8 класс
Дополнительная информация к изучению темы "Вода, растворы"
вода
Publish at Calameo or read more publications.
вторник, 21 января 2014 г.
среда, 15 января 2014 г.
воскресенье, 12 января 2014 г.
Растворы 8 класс
Ребята, расчетные задачи решите в классных тетрадях, а затем проставьте свои ответы в тесте. Думаю, что с 1 и 2 задачей вы справились легко, в вот с третьей задачей поразмышляйте, мы не решали задачи такого типа на уроке. напишите в комментариях, у кого сразу получился правильный ответ. Успехов!
пятница, 10 января 2014 г.
Азотная кислота, нитраты 9 класс
Готовимся к зачету по азоту и его соединениям. Особое внимание - аммиак, азотная кислота, нитраты. Информация по нитратам
Задание из ГИА: В трех пронумерованных пробирках без этикеток находятся гидроксид натрия, сульфат натрия, нитрат натрия. Как химическим путем определить вещества. Напишите уравнения возможных реакций.
Потренируйтесь
Задание из ГИА: В трех пронумерованных пробирках без этикеток находятся гидроксид натрия, сульфат натрия, нитрат натрия. Как химическим путем определить вещества. Напишите уравнения возможных реакций.
Потренируйтесь
Подписаться на:
Сообщения (Atom)



























