суббота, 29 декабря 2012 г.
вторник, 25 декабря 2012 г.
Зачет в 11А
Сегодня в 11А состоялся зачет по теме "Классификация неорганических соединений". Материал урока не оставил равнодушными учащихся, и спонтанно, перед началом урока родилась небольшая музыкальная зарисовка.
пятница, 21 декабря 2012 г.
Натрий и его соединения
Презентация " Характеристика химического элемента - натрия" выполнена Васнихиным Виктором, учеником 9Б класса. Информация может быть использована при подготовке к экзаменам.
Более подробная информация о применении натрия и его соединений
Более подробная информация о применении натрия и его соединений
понедельник, 17 декабря 2012 г.
Щелочные металлы I группы главной подгруппы
План характеристики химического элемента
1. Положение в ПС
период, ряд, группа, подгруппа, заряд ядра атома (протоны нейтроны электроны), энергетические уровни, подуровни, квантовые ячейки, S, P, D элемент, валентность, формула простого вещества, формула высшего оксида и ЛВС
2.История открытия химического элемента
3.Нахождение в природе.
4. Получение
5.Физические свойства
6.Химические свойства
7.Применение.
Видеоурок "Щелочные металлы I группы главной подгруппы " здесь
В помощь для подготовки к уроку " Периодическая система химических элементов" , ссылка на моем блоге в разделе для любознательных, много интересной информации, обязательно посмотрите и используйте.
1. Положение в ПС
период, ряд, группа, подгруппа, заряд ядра атома (протоны нейтроны электроны), энергетические уровни, подуровни, квантовые ячейки, S, P, D элемент, валентность, формула простого вещества, формула высшего оксида и ЛВС
2.История открытия химического элемента
3.Нахождение в природе.
4. Получение
5.Физические свойства
6.Химические свойства
7.Применение.
Видеоурок "Щелочные металлы I группы главной подгруппы " здесь
В помощь для подготовки к уроку " Периодическая система химических элементов" , ссылка на моем блоге в разделе для любознательных, много интересной информации, обязательно посмотрите и используйте.
пятница, 14 декабря 2012 г.
Состав воздуха
Нас ждет очень интересная тема урока "Состав воздуха". Такое банальное словосочетание, а сколько за ним исследований, непредсказуемых открытий и торжества науки. Великие химики, уже знакомые нам по работам с кислородом, Д.Пристли и А.Лавуазье, были первыми и здесь. После долгих лабораторных исследований Антуан Лавуазье установил, что в состав воздуха входят два газа - азот и кислород. Кстати, именно Лавуазье предложил термин азот, что в переводе означает "безжизненный". Азот - химически неактивный газ, проявляет себя только при температурах свыше 2000 С или в других особых условиях. Это хорошо? ЗАМЕЧАТЕЛЬНО! Почему?
Содержание углекислого газа в воздухе - 0,03 %, это хорошо? А давайте увеличим....немножко. Нас ждет ....... эффект
воздух
Publish at Calameo or read more publications.
Жду ваших комментариев!
Интересные опыты с ртутью здесь
Интересные опыты с ртутью здесь
Металлы, сплавы, получение металлов 9 класс
Информации по теме урока в книге недостаточно, презентации в помощь.
среда, 5 декабря 2012 г.
пятница, 30 ноября 2012 г.
Для 8А и 8Б классов
По теме "Решение расчетных задач" выполняем тест, весь ход решения задач в классной тетради.
четверг, 29 ноября 2012 г.
Химическое шоу!
Дна дня в нашей гимназии работали представители
Великолепные, зрелищные , очень познавательные химические опыты. Интересно было всем- и учащимся начальной школы, и старшеклассникам. Я в своей работе уже обращалось к копилке опытов, любезно размещенных на сайте этого шоу. Спасибо команде профессора Николя за пропаганду знаний, за создание доброжелательной , искрометной обстановки, за любовь к детям.вторник, 27 ноября 2012 г.
Решение расчетных задач по химическим уравнениям
Информация для 8А и 8Б классов была выложена в прошлом учебном году, актуальна и сейчас, поэтому обязательно оставляем комментарии.
Решение расчетных задач по химическим уравнениям здесь

Решение расчетных задач по химическим уравнениям здесь

понедельник, 26 ноября 2012 г.
Контрольная работа 8 классы
Итоги контрольной работы, даже скорее всего зачетной работы, по решению расчетных задач приятно удивили. В 8А классе на "отлично" выполнили работу -
Лопушанский Игорь, Стариско Ксения, Котин Евгений, Черных Лариса.
В 8Б - Алексеева Вика, Баскова Настя, Виницкая Маша, Игнатюк Антон, Николаев Артем, Смирнова Настя, Федоров Андрей.
Учащиеся 8Б класса, МОЛОДЦЫ! Поздравляю!
Лопушанский Игорь, Стариско Ксения, Котин Евгений, Черных Лариса.
В 8Б - Алексеева Вика, Баскова Настя, Виницкая Маша, Игнатюк Антон, Николаев Артем, Смирнова Настя, Федоров Андрей.
Учащиеся 8Б класса, МОЛОДЦЫ! Поздравляю!
понедельник, 12 ноября 2012 г.
Количественные отношения в химии, 8 класс
В химии, как и в физике, существует раздел, изучающий количественные отношения реагирующих веществ, проще говоря, материал, позволяющий нам производить расчеты по химическим формулам и уравнениям.
Самые главные величины - это молярная масса, масса вещества, моль, молярный объем.
Информация о моле, как основной расчетной величине здесь
Тест 1
"Взаимосвязь между числом Авогадро, количеством вещества" здесь
Тест 2
"Взаимосвязь между массой вещества, количеством вещества и молярной массой" здесь
тест 3 здесь
тест 4 здесь
тест 5 здесь
тест 6 здесь
Самые главные величины - это молярная масса, масса вещества, моль, молярный объем.
Информация о моле, как основной расчетной величине здесь
Тест 1
"Взаимосвязь между числом Авогадро, количеством вещества" здесь
Тест 2
"Взаимосвязь между массой вещества, количеством вещества и молярной массой" здесь
тест 3 здесь
тест 4 здесь
тест 5 здесь
тест 6 здесь
понедельник, 29 октября 2012 г.
Окислительно- восстановительные реакции
Реакции, протекающие с изменением степени окисления, называются окислительно-восстановительными.
Степень окисления (СО) - это условный заряд, который приобретает атом, если он отдает или присоединяет электроны.
всю презентацию можно посмотреть здесь
Восстановитель -
это химический элемент, который отдает электроны, и повышает СО.
Окислитель - это химический элемент, который забирает электроны и понижает СО.
Как составить электронный баланс?
Он очень удобен для подбора коэффициентов в уравнении реакции.
Информация здесь
Степень окисления (СО) - это условный заряд, который приобретает атом, если он отдает или присоединяет электроны.
всю презентацию можно посмотреть здесь
Восстановитель -
это химический элемент, который отдает электроны, и повышает СО.
Окислитель - это химический элемент, который забирает электроны и понижает СО.
Как составить электронный баланс?
Он очень удобен для подбора коэффициентов в уравнении реакции.
Информация здесь
среда, 24 октября 2012 г.
Алкадиены
В названии появляется суффикс диен, углеводороды содержат две двойные связи с общей формулой CnH2n-2.
Номенклатура алкадиенов здесь
Конструктор молекул здесь, хотя , конечно, "детский сад" для учащихся 10-х классов
Типы двойных связей в диенах:
1. изолированные, двойные связи разделены двумя или более атомам и углерода
Н2С= СН- СН2- СН= СН2
2.кумулированные, расположены у одного атома углерода Н2С=С=СН2
3.сопряженные, разделены одной сигма связью Н2С= СН - СН =СН2
Номенклатура алкадиенов здесь
Конструктор молекул здесь, хотя , конечно, "детский сад" для учащихся 10-х классов
Типы двойных связей в диенах:
1. изолированные, двойные связи разделены двумя или более атомам и углерода
Н2С= СН- СН2- СН= СН2
2.кумулированные, расположены у одного атома углерода Н2С=С=СН2
3.сопряженные, разделены одной сигма связью Н2С= СН - СН =СН2
вторник, 23 октября 2012 г.
Типы химических реакций
Химические реакции можно разделить на четыре основных типа:
разложения, соединения,замещения, обмена.
Реакции соединения
Определение реакции соединения здесь, а тестовое задание здесь
Реакции разложения
Определение реакции соединения здесь , а тестовое задание здесь
Реакции замещения
Определение реакции замещения здесь, а тестовое задание здесь
Реакции обмена
Определение реакции обмена здесь, а тестовое задание здесь
разложения, соединения,замещения, обмена.
Реакции соединения
Определение реакции соединения здесь, а тестовое задание здесь
Реакции разложения
Определение реакции соединения здесь , а тестовое задание здесь
Реакции замещения
Определение реакции замещения здесь, а тестовое задание здесь
Реакции обмена
Определение реакции обмена здесь, а тестовое задание здесь
среда, 17 октября 2012 г.
Экзотермические и эндотермические реакции
Разбирали с учащимися 11-х классов скучноватую тему "Классификация химических реакций", и когда разговор зашел о реакциях , идущих с поглощением теплоты, возник вопрос девушек 11 класса: "А можно ли посмотреть такую реакцию?" Да, можно.
По заявкам, эндотермическая реакция растворения нитрата аммония в воде
А экзотермическую реакцию посмотрим на уроке "в живую", есть соответствующие вещества.
По заявкам, эндотермическая реакция растворения нитрата аммония в воде
А экзотермическую реакцию посмотрим на уроке "в живую", есть соответствующие вещества.
вторник, 16 октября 2012 г.
Химические свойства алкенов
Алкены- непредельные углеводороды, содержащие одну двойную связь.
Для алкенов характерны реакции:
- горения
- галогенирования
- гидрогалогенирования
- гидратации
- гидрирование
- окислением раствора перманганата калия
- реакция полимеризации
Качественной реакцией на алкены является реакция с бромной водой и ее обесцвечивание.
а также взаимодействие с раствором перманганат а калия
вторник, 9 октября 2012 г.
Курсы
Уважаемые коллеги!
Для желающих повысить свой профессиональный уровень, а также пообщаться с целеустремленными, грамотными, интересными педагогами, образовательный центр "Интокс" производит набор в следующие группы:
информация здесь
Для тех, кто хочет получить бумажку об окончании курсов и после этого работать по старому, обращаться к этой информации не имеет смысла.
пятница, 5 октября 2012 г.
среда, 3 октября 2012 г.
Химические уравнения
Закон сохранения массы веществ, открытый М.В. Ломоносовым в 1756 г., гласит
"Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции".
Подробнее можно посмотреть здесь
На основании этого закона составляются химические уравнения.Информация здесь
Расстановка коэффициентов в уравнении - тесты здесь, выполняем в тетради и проверяем на блоге.
В химическом уравнении количество атомов химического элемента в левой части должно быть равно количеству элементов в правой части. Как уравнять? Конечно, при помощи коэффициентов. Тогда уравнение реакции считается законченным.
А какие уравнения подходят под эту категорию? Это здесь . Выберите уравнения и аргументируйте свой ответ.
Успехов!

"Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции".
Подробнее можно посмотреть здесь
На основании этого закона составляются химические уравнения.Информация здесь
Расстановка коэффициентов в уравнении - тесты здесь, выполняем в тетради и проверяем на блоге.
В химическом уравнении количество атомов химического элемента в левой части должно быть равно количеству элементов в правой части. Как уравнять? Конечно, при помощи коэффициентов. Тогда уравнение реакции считается законченным.
А какие уравнения подходят под эту категорию? Это здесь . Выберите уравнения и аргументируйте свой ответ.
Успехов!

понедельник, 1 октября 2012 г.
Готовимся к ГИА 9А, 9Б класс
Информацию о проведении ГИА в 2013 году по химии смотри здесь.
Блог "С химией по жизни"
Тематический тест из ГИА по теме "Ионные уравнения".
Необратимо протекает реакция ионного обмена между растворами:
1. сульфата алюминия и нитрата калия
2. серной кислоты и карбоната кальция
3.гидроксида натрия и хлорида бария
4.нитрата натрия и соляной кислоты
И еще посмотреть и проверить здесь
Записать уравнения в молекулярной и ионной форме.
Блог "С химией по жизни"
Тематический тест из ГИА по теме "Ионные уравнения".
Необратимо протекает реакция ионного обмена между растворами:
1. сульфата алюминия и нитрата калия
2. серной кислоты и карбоната кальция
3.гидроксида натрия и хлорида бария
4.нитрата натрия и соляной кислоты
И еще посмотреть и проверить здесь
Записать уравнения в молекулярной и ионной форме.
Физические и химические явления
Явления можно разделить на физические и химические.
При физических явлениях происходит изменение только агрегатного состояния вещества. Например, плавление стекла, испарение или замерзание воды.
При химических явлениях происходит превращение одних веществ в другие. Иначе химические явления называют химическими реакциями.
Признаки химических реакций - это:
1.образование осадка;
2.изменение цвета;
3.выделение газа;
4.появление запаха;
5.выделение теплоты.
Информация о признаках химических реакций здесь и здесь
Ответы принимаются до 22.00. Доступ к документу - 22.20

При физических явлениях происходит изменение только агрегатного состояния вещества. Например, плавление стекла, испарение или замерзание воды.
При химических явлениях происходит превращение одних веществ в другие. Иначе химические явления называют химическими реакциями.
Признаки химических реакций - это:
1.образование осадка;
2.изменение цвета;
3.выделение газа;
4.появление запаха;
5.выделение теплоты.
Информация о признаках химических реакций здесь и здесь
Ответы принимаются до 22.00. Доступ к документу - 22.20

пятница, 28 сентября 2012 г.
пятница, 21 сентября 2012 г.
Валентность 8А, 8Б класс
Мы говорили с вами о том, что химическая формула отображает состав вещества при помощи химических знаков и индексов. Рассмотрим формулы веществ, в состав которых входит химический элемент водород, HCL H2O NH3 CH4.
Почему количество атомов водорода разное?
Это можно объяснить только валентностью химических элементов.
I II I III
Н O Na Fe
Валентность бывает постоянной и переменной.
У кислорода - всегда II, у серы - II, IV, VI.
Почему количество атомов водорода разное?
Это можно объяснить только валентностью химических элементов.
Валентность - это способность химического элементам присоединять к себе определенное количество атомов других элементов.
Валентность обозначается римскими цифрами и ставится над элементом.I II I III
Н O Na Fe
Валентность бывает постоянной и переменной.
У кислорода - всегда II, у серы - II, IV, VI.
Валентность химических элементов
постоянная
I H Na K Li
II O Mg Ca Ba Zn
III Al B
Чтобы составить формулу по валентности, необходимо соблюдать следующий порядок действий:
1.написать знаки химических элементов
AL O
2.проставить над ними валентность
III II
AL O
3. найти наименьшее общее кратное (НОК) - в данном случае - 6
4. разделить НОК на валентность каждого элемента и проставить индексы
6
6
III II
AL2 O3
И еще, если валентность химических элементов одинакова, то формула остается без изменений.
И еще, если валентность химических элементов одинакова, то формула остается без изменений.
понедельник, 17 сентября 2012 г.
Реакции ионного обмена 9А, 9Б класс
В водных растворах все электролиты распадаются на ионы и реакции происходят между ионами. Существуют ли какие-нибудь закономерности в протекании таких реакций?
- если образуется осадок;
- если выделяется газ;
- если образуется малодиссоциируюшее вещество, например - вода.
В домашних тетрадях записать уравнения возможных реакций в молекулярном, ионном полном и сокращенном виде, выбрав их из предложенного списка.
Список здесь

Через несколько уроков практическая работа по растворам, поэтому небольшое напоминание!
четверг, 13 сентября 2012 г.
Молекулы, атомы. Простые и сложные вещества. 8А и 8Б класс
Из курса физики нам уже известно, что многие вещества состоят из молекул.
Молекулы (от латинск. "moles" масса)- это мельчайшие частицы, химически делимые. Молекулы состоят из атомов.
Атом- это мельчайшие химически неделимые частицы вещества.
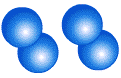
Молекула кислорода О2, состоит из двух атомов кислорода
простое вещество
 молекула озона О3, состоит из трех атомов кислорода
молекула озона О3, состоит из трех атомов кислорода
простое вещество
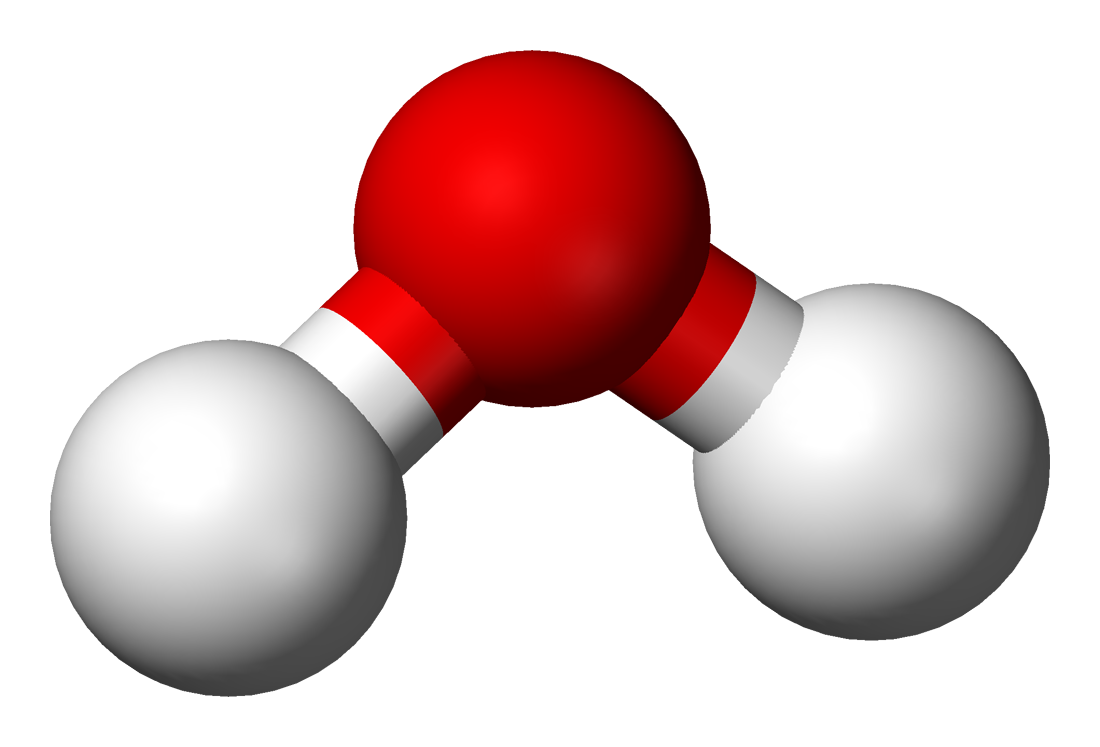
молекула воды Н2О состоит из двух атомов водорода и одного атома кислорода
сложное вещество
Если атомы одного вида соединяются вместе, то образуется простое вещество.
При взаимодействии атомов разных видов образуются сложные вещества.
Примеры сложных и простых веществ можно посмотреть здесь
А проверить свои знания нужно здесь
Успехов!
Молекулы (от латинск. "moles" масса)- это мельчайшие частицы, химически делимые. Молекулы состоят из атомов.
Атом- это мельчайшие химически неделимые частицы вещества.

Молекула кислорода О2, состоит из двух атомов кислорода
простое вещество
 молекула озона О3, состоит из трех атомов кислорода
молекула озона О3, состоит из трех атомов кислородапростое вещество

молекула воды Н2О состоит из двух атомов водорода и одного атома кислорода
сложное вещество
Если атомы одного вида соединяются вместе, то образуется простое вещество.
При взаимодействии атомов разных видов образуются сложные вещества.
Примеры сложных и простых веществ можно посмотреть здесь
А проверить свои знания нужно здесь
Успехов!
вторник, 11 сентября 2012 г.
Диссоциация кислот, оснований, солей 9А,9Б класс
Итак, на прошлом уроке мы выяснили, что к категории электролитов относятся растворимые кислоты, соли, основания (см.таблицу растворимости).
На какие ионы распадаются кислоты?
Предположу, что на ионы водорода и кислотного остатка. (проверим на опыте и уточним формулировку).
А чтобы еще раз вспомнить материал по классификации сложных веществ, пройдите интерактивные тесты:
На какие ионы распадаются кислоты?
Предположу, что на ионы водорода и кислотного остатка. (проверим на опыте и уточним формулировку).
А чтобы еще раз вспомнить материал по классификации сложных веществ, пройдите интерактивные тесты:
- кислоты здесь
- основания здесь
- соли здесь
- оксиды здесь; в задании пусть вас не смущает слово солеобразующий оксид, подумайте, это оксид, которому должна соответствовать определенная кислота (оксид+вода).
четверг, 6 сентября 2012 г.
Знаки химических элементов 8А,8Б класс
Итак, для учащихся 8А и 8Б классов, первая информация и первое тестовое задание на блоге.
Для того, чтобы знать химию, необходимо изучить химический язык. Что это такое? Читаем здесь.
Спрашиваю, и сама отвечаю -это знаки химических элементов. Сколько химических элементов содержит современная периодическая система? Около 110 элементов. Многовато для первого знакомства, поэтому мы возьмем для изучения знаки 25 химических элементов.
В 1814г шведский химик Й.Я.Берцелиус ввел современное обозначение химических элементов.
Информация здесь
Для всех, не только для любознательных, обязательно читаем:
- астрономические названия химических элементов здесь
- географические названия химических элементов здесь
- названия химических элементов в честь ученых здесь
А здесь можно подсмотреть, хотя вся информация у вас в рабочей тетради.
Успехов!


Электролитическая диссоциация 9А, 9Б классы
Мы приступаем к изучению раздела "Электролитическая диссоциация"
Что происходит с веществами под воздействием молекул воды?
1.Электролиты и неэлектролиты.
Какие классы, раннее изученных нами веществ, мы можем отнести к этой категории?
Ответ здесь.
Сущность процесса электролитической диссоциации здесь
Основные положения теории электролитической диссоциации были разработаны шведским ученым, Нобелевским лауреатом Сванте Аррериусом в 1887 году. Ознакомиться с биографией ученого можно здесь.

Что происходит с веществами под воздействием молекул воды?
1.Электролиты и неэлектролиты.
Какие классы, раннее изученных нами веществ, мы можем отнести к этой категории?
Ответ здесь.
Сущность процесса электролитической диссоциации здесь
Основные положения теории электролитической диссоциации были разработаны шведским ученым, Нобелевским лауреатом Сванте Аррериусом в 1887 году. Ознакомиться с биографией ученого можно здесь.
понедельник, 3 сентября 2012 г.
Начался новый учебный год!
К нам присоединяются учащиеся 8А и 8Б классов! Рада приветствовать вас на страницах своего блога.
По мере изучения материала на блоге будет выкладываться информация, читать блог необходимо перед каждым уроком химии.
Свои вопросы и пожелания можно, даже необходимо, оставлять в комментариях. Думаю, что наше общение будет позитивным.
К нам присоединяются учащиеся 8А и 8Б классов! Рада приветствовать вас на страницах своего блога.
По мере изучения материала на блоге будет выкладываться информация, читать блог необходимо перед каждым уроком химии.
Свои вопросы и пожелания можно, даже необходимо, оставлять в комментариях. Думаю, что наше общение будет позитивным.
вторник, 21 августа 2012 г.
пятница, 8 июня 2012 г.
Наш Менделеев
Подводим итоги нашей замечательной экскурсии "Жизнь и научная деятельность Д.И.Менделеева"
Карта нашего маршрута здесь.
Окончательная редакция карты выполнена Цукановой Лизой.
Работа в группах по темам:
"Памятники Д.И.Менделееву в Санкт-Петербурге" здесь
" Интересные факты биографии великого ученого" здесь
"Научная деятельность ученого" здесь
"Родословная семьи Менделеевых" здесь
Фотографии с экскурсии здесь, смотрите и комментируйте.
Фотографии предоставлены Козырицкой Настей, Пташник Машей, Савенец Светланой, Фотуйма Викой.
Небольшие зарисовки, авторский вариант:
"Как мы проводим свободное время " - Козырицкая Настя
"Наш Менделеев" - Трусов Игорь
"Сказочка про фею" - Григорян Лилит
"Наш Менделеев" - Фотуйма Вика и Пташник Маша
Карта нашего маршрута здесь.
Окончательная редакция карты выполнена Цукановой Лизой.
Работа в группах по темам:
"Памятники Д.И.Менделееву в Санкт-Петербурге" здесь
" Интересные факты биографии великого ученого" здесь
"Научная деятельность ученого" здесь
"Родословная семьи Менделеевых" здесь
Фотографии с экскурсии здесь, смотрите и комментируйте.
Фотографии предоставлены Козырицкой Настей, Пташник Машей, Савенец Светланой, Фотуйма Викой.
Небольшие зарисовки, авторский вариант:
"Как мы проводим свободное время " - Козырицкая Настя
"Наш Менделеев" - Трусов Игорь
"Сказочка про фею" - Григорян Лилит
"Наш Менделеев" - Фотуйма Вика и Пташник Маша
четверг, 24 мая 2012 г.
Звенят последние звонки....
Поздравляю своих любимых учеников 9А, 9Б, 11А классов с окончанием учебного года.
Везения на экзаменах, пусть достанутся вам те билеты, которые вы хорошо знаете, а даже если вдруг судьба сыграет с вами злую шутку, то в момент сдачи пусть наступит озарение! Успехов!

Везения на экзаменах, пусть достанутся вам те билеты, которые вы хорошо знаете, а даже если вдруг судьба сыграет с вами злую шутку, то в момент сдачи пусть наступит озарение! Успехов!

среда, 23 мая 2012 г.
Да здравствует блог и mimio
Ребята! Мы заканчиваем с вами учебный год, хотелось бы подвести итог, ваш результат- ваши оценки в году, и не только. Наверное, что-то большее.
Прошу вас ответить на вопросы моей анкеты. Подойдите к этому обдуманно и серьезно, для меня это очень важно.
Обязательно оставляем свое мнение в комментариях, мой девиз "Да здравствует блог и mimio" поддерживают???? или !!! Что изменилось для вас в изучении химии, когда на уроках стала использоваться доска mimio ?
Спасибо!Прошу вас ответить на вопросы моей анкеты. Подойдите к этому обдуманно и серьезно, для меня это очень важно.
Обязательно оставляем свое мнение в комментариях, мой девиз "Да здравствует блог и mimio" поддерживают???? или !!! Что изменилось для вас в изучении химии, когда на уроках стала использоваться доска mimio ?
четверг, 10 мая 2012 г.
Зачет в 9-х классах "Кремний и его соединения"
Ребята, мы закончили с вами изучение неорганической химии. Сдан последний зачет, еще несколько уроков и окончание учебного года.
Зачет вы сдали очень хорошо, даже можно сказать превосходно и,
конечно, отмечаем лучшие ответы.
1.Кремний. Характеристика химического элемента.
Экзаменаторы: Тормасова Полина, Веселова Наташа.
Лучшие ответы: Соколов Иван, Сальникова Евгения, Филипенков Даниил, Брекелева Женя
2. Соединения кремния.
Экзаменаторы: Евтухов Семен, Красова Настя
Лучшие ответы: Ромина Вероника, Шалаева Саша, Кудрявцева Катя
3.Фарфор, керамика.
Экзаменаторы: Ткачев Павел, Колчин Алексей, Харитонова Оля
Лучшие ответы: Котов Михаил, Кудрявцева Катя, Круглолицев Александр
4.Цемент, стекло
Экзаменаторы: Молодцова Татьяна, Снурникова Лена
Лучшие ответы: Кузнецова Катя, Сальникова Женя, Кудрявцева Катя.
Зачет вы сдали очень хорошо, даже можно сказать превосходно и,
конечно, отмечаем лучшие ответы.
1.Кремний. Характеристика химического элемента.
Экзаменаторы: Тормасова Полина, Веселова Наташа.
Лучшие ответы: Соколов Иван, Сальникова Евгения, Филипенков Даниил, Брекелева Женя
2. Соединения кремния.
Экзаменаторы: Евтухов Семен, Красова Настя
Лучшие ответы: Ромина Вероника, Шалаева Саша, Кудрявцева Катя
3.Фарфор, керамика.
Экзаменаторы: Ткачев Павел, Колчин Алексей, Харитонова Оля
Лучшие ответы: Котов Михаил, Кудрявцева Катя, Круглолицев Александр
4.Цемент, стекло
Экзаменаторы: Молодцова Татьяна, Снурникова Лена
Лучшие ответы: Кузнецова Катя, Сальникова Женя, Кудрявцева Катя.
среда, 9 мая 2012 г.
Химическая связь
Различают следующие виды химической связи: ковалентная неполярная, ковалентная полярная, ионная. Для определения вида связи используют понятие электроотрицательность (ЭО).
ЭО - это способность элемента оттягивать на себя электроны от атомов других элементов.
Таблица ЭО химических элементов находится на блоге в разделе таблицы по химии, посмотрите.
Образование ковалентной неполярной связи здесь.
Образование ковалентной полярной связи здесь.
Образование ионной связи здесь.
И, конечно, обязательно, на закрепление материала тест.
ЭО - это способность элемента оттягивать на себя электроны от атомов других элементов.
Таблица ЭО химических элементов находится на блоге в разделе таблицы по химии, посмотрите.
Образование ковалентной неполярной связи здесь.
Образование ковалентной полярной связи здесь.
Образование ионной связи здесь.
И, конечно, обязательно, на закрепление материала тест.
четверг, 3 мая 2012 г.
Экскурсия "Наш Менделеев"
Мы отправляемся с вами на экскурсию "Наш Менделеев".
15 мая (вторник), 9.30 от гимназии по следующему маршруту:
1.Метро "Финляндский вокзал" - метро "Адмиралтейская"
2. Музей- квартира Д.И.Менделеева, Университетская набережная д.7\9
3.Метро "Технологический институт", Московский проспект д.19.
Памятник Д.И.Менделееву, панно "Периодическая система химических элементов",
дом, в котором проживала семья ученого, технологический институт.
4.Метро "Волковская" , Волковское кладбище, могила Д.И.Менделеева
Доступ к карте вы получили по электронной почте. Карта здесь.
Просмотреть Д.И.Менделеев в Санкт-Петербурге на карте большего размера
Предварительно знакомимся с заданиями к экскурсии. Самостоятельно разбиваемся на 4 группы. Зайдите в документ ( группа №...) и запишите свою фамилию в графе участники.
Группа №1 - "Памятники Д.И.Менделееву в Санкт-Петербурге"
Группа №2 - " Интересные факты биографии великого ученого"
Группа №3 - "Научная деятельность ученого"
Группа №4 - "Родословная семьи Менделеевых".
Каждый из вас делает свой фоторепортаж, 4 наиболее удачные фотографии выгружает в совместный альбом,
1. Открываем свою почту на gmail. Там вас ожидает ссылка-приглашение в наш общий фотоальбом. Жмем на ссылку, заходим в альбом.
2. Каждый из нас загружает в альбом 4 фотографии .
3. Автор снимка подбирает фотографии название и размещает в поле "Подпись к фотографии". Альбом Picasa здесь
Каждая группа заполняет отчет по экскурсии на своем листе (группа№..) и оформляет презентацию.
Презентации:
Группа №1 - здесь
Группа №2 - здесь
Группа №3 - здесь
Группа №4 - здесь
Каждая группа работает с Google картой, отмечая на ней объекты метками. Объект необходимо описать.
Как это сделать? Инструкция.
Совместную работу начнем после экскурсии, во вторник, каждый за своим компьютером, время согласуем.
Информация по экскурсии будет обновляться, дополняться, внимательно знакомьтесь с заданиями.
среда, 2 мая 2012 г.
Дмитрий Иванович Менделеев
Сообщение подготовлено учеником 8Б класса, Кобыляченко Семеном.
Дмитрий Иванович Менделеев родился 8 февраля 1834 года в селе Верхние Аремзяны недалеко от Тобольска, в семье директора гимназии и попечителя училищ. Он был семнадцатым ребенком в семье. Воспитывала его мать, поскольку отец будущего химика вскоре после его рождения умер. В 15 лет Дмитрий Менделеев окончил гимназию.
Его мать приложила немало усилий, чтобы юноша продолжил образование. В 1850 году он поступает в Главный педагогический институт в Москве, где когда-то учился его отец. В возрасте 21 года Менделеев блестяще выдержал выпускные экзамены, а его дипломная работа о явлении изоморфизма была признана кандидатской диссертацией.
В 1857 году Менделеев стал приват-доцентом при Петербургском Университете. 1859-1861 годы провел на стажировке в различных университетах Франции и Германии. В 1859 году он сконструировал пикнометр – прибор для определения плотности жидкости, в 1860 году открыл критическую температуру абсолютного кипения жидкостей.
В 1863 году вышел его учебник «Органическая химия», который был удостоен Демидовской премии. В 1865 году Менделеев защитил докторскую диссертацию, в которой заложил основы нового учения о растворах, и стал профессором Петербургского университета. Преподавал Менделеев и в других высших учебных заведениях.
Открытие Менделеевым в 1869 году периодического закона стало не только одним из крупнейших событий в истории химии 19 столетия, но и в известном смысле одним из самых выдающихся достижений человеческой мысли минувшего тысячелетия.
2 февраля 1907 года. Менделеев скончался. В его честь назван элемент № 101 – менделевий.
Дмитрий Иванович Менделеев родился 8 февраля 1834 года в селе Верхние Аремзяны недалеко от Тобольска, в семье директора гимназии и попечителя училищ. Он был семнадцатым ребенком в семье. Воспитывала его мать, поскольку отец будущего химика вскоре после его рождения умер. В 15 лет Дмитрий Менделеев окончил гимназию.
Его мать приложила немало усилий, чтобы юноша продолжил образование. В 1850 году он поступает в Главный педагогический институт в Москве, где когда-то учился его отец. В возрасте 21 года Менделеев блестяще выдержал выпускные экзамены, а его дипломная работа о явлении изоморфизма была признана кандидатской диссертацией.
В 1857 году Менделеев стал приват-доцентом при Петербургском Университете. 1859-1861 годы провел на стажировке в различных университетах Франции и Германии. В 1859 году он сконструировал пикнометр – прибор для определения плотности жидкости, в 1860 году открыл критическую температуру абсолютного кипения жидкостей.
В 1863 году вышел его учебник «Органическая химия», который был удостоен Демидовской премии. В 1865 году Менделеев защитил докторскую диссертацию, в которой заложил основы нового учения о растворах, и стал профессором Петербургского университета. Преподавал Менделеев и в других высших учебных заведениях.
Открытие Менделеевым в 1869 году периодического закона стало не только одним из крупнейших событий в истории химии 19 столетия, но и в известном смысле одним из самых выдающихся достижений человеческой мысли минувшего тысячелетия.
2 февраля 1907 года. Менделеев скончался. В его честь назван элемент № 101 – менделевий.
четверг, 26 апреля 2012 г.
Жизнь и деятельность Д.И.Менделеева
Биография Д.И.Менделеева Здесь
Дмитрий Иванович Менделеев - гениальный русский ученый и общественный деятель.
Широко известен как химик, физик, экономист, метролог, технолог, геолог, метеоролог, педагог, воздухоплаватель.
Глядя на портреты ученых, поэтов мы не задумываемся над тем, что они такие же люди, как мы с вами. Для нас они старые, усатые, неинтересные внешне.
Такой обязательный "иконостас", который есть в каждом школьном кабинете.
Когда начинаешь знакомиться с биографией, восприятие человека меняется. Оказывается, они любили, ненавидели, делали в своей жизни ошибки, совершали подвиги и поступки.
Давайте отправимся на экскурсию по местам, где жил и работал Дмитрий Иванович, а потом посмотрим, как мы будем с вами относится и к портрету великого ученого, и к периодической системе химических элементов, и к сухой фразе - гениальный русский ученый.
вторник, 24 апреля 2012 г.
Характеристика химического элемента
Вот мы и заканчиваем с вами изучение Периодической системы Д.И.Менделеева, осталось несколько уроков и, конечно, небольшой зачет по пройденному материалу.
Тот, кто проболел, читайте все мои сообщения на блоге, подходите с вопросами.
Для помощи, выкладываю план характеристики химического элемента и проверочный тест.
1.Элемент
2.Период, ряд, группа, подгруппа
3.Заряд ядра, количество энергетических уровней, количество электронов
4.Количество протонов, электронов, нейтронов
5.Электронная формула, квантовые ячейки
6. S, P элемент
7.Валентность (количество электронов на последнем уровне)
8.Металл, неметалл
9.Формула высшего оксида, характер (основный, кислотный, амфотерный), какое основание или кислота соответствуют
10.Летучее водородное соединение
Интерактивные тесты
Характеристика металла по ПС здесь
Характеристика неметалла по ПС здесь

Тот, кто проболел, читайте все мои сообщения на блоге, подходите с вопросами.
Для помощи, выкладываю план характеристики химического элемента и проверочный тест.
1.Элемент
2.Период, ряд, группа, подгруппа
3.Заряд ядра, количество энергетических уровней, количество электронов
4.Количество протонов, электронов, нейтронов
5.Электронная формула, квантовые ячейки
6. S, P элемент
7.Валентность (количество электронов на последнем уровне)
8.Металл, неметалл
9.Формула высшего оксида, характер (основный, кислотный, амфотерный), какое основание или кислота соответствуют
10.Летучее водородное соединение
Интерактивные тесты
Характеристика металла по ПС здесь
Характеристика неметалла по ПС здесь
четверг, 19 апреля 2012 г.
Зачет в 9-х классах
По итогам зачета в 9А и 9Б классах.
Наибольшее количество баллов набрали:
9А класс Молодцова Татьяна и Гроздова Анастасия
9Б класс Веселова Наталья, Недведская Анастасия
Экзаменаторы отмечают лучшие ответы
1.Аллотропия углерода
Недведская Настя, Тормасова Полина, Минина Саша
2.Оксиды углерода
Недведская Настя, Тормасова Полина, Филипенков Даниил
3.Карбонаты и гидрокарбонаты
Авраменко Лена, Тормасова Полина, Круглолицев Саша
4.Решение задач
Смешкаль Дима, Молодцова Таня, Симонов Влад
Фотографии с зачета на странице блога "Странички школьной жизни"
Наибольшее количество баллов набрали:
9А класс Молодцова Татьяна и Гроздова Анастасия
9Б класс Веселова Наталья, Недведская Анастасия
ПОЗДРАВЛЯЕМ!
1.Аллотропия углерода
Недведская Настя, Тормасова Полина, Минина Саша
2.Оксиды углерода
Недведская Настя, Тормасова Полина, Филипенков Даниил
3.Карбонаты и гидрокарбонаты
Авраменко Лена, Тормасова Полина, Круглолицев Саша
4.Решение задач
Смешкаль Дима, Молодцова Таня, Симонов Влад
Фотографии с зачета на странице блога "Странички школьной жизни"
Изменение свойств химических элементов в периодах и группах
Ребята, изучая структурные элементы периодической системы, мы отметили, как изменяются химические свойства в периодах и группах.
Объяснить этот факт с точки зрения строения атома, мы не могли, так как не знали строение атома химического элемента.
Сейчас мы можем сказать, что периодическое изменение свойств в периодах связано с накоплением электронов на внешнем уровне, а в группах, с увеличением энергетических уровней.
1.Изменение свойств химических элементов здесь
2.Периодический Закон и периодическая система здесь
Света Савенец невольно подбросила идею о названии химических элементов. Я нашла вам информацию, в честь чего и кого были названы некоторые химические элементы. Знакомьтесь.
Этимология названия химических элементов.
Географические названия. Здесь.
Астрономические названия здесь.
Имена ученых здесь
Названия, заимствованные из мифологии здесь

Объяснить этот факт с точки зрения строения атома, мы не могли, так как не знали строение атома химического элемента.
Сейчас мы можем сказать, что периодическое изменение свойств в периодах связано с накоплением электронов на внешнем уровне, а в группах, с увеличением энергетических уровней.
1.Изменение свойств химических элементов здесь
2.Периодический Закон и периодическая система здесь
Света Савенец невольно подбросила идею о названии химических элементов. Я нашла вам информацию, в честь чего и кого были названы некоторые химические элементы. Знакомьтесь.
Этимология названия химических элементов.
Географические названия. Здесь.
Астрономические названия здесь.
Имена ученых здесь
Названия, заимствованные из мифологии здесь
четверг, 12 апреля 2012 г.
Состояние электронов в атомах
Электроны в атомах могут находиться на различных расстояниях от ядра. Можно говорить лишь о вероятности пребывания электронов на определенном расстоянии. Область пребывания электронов в ядре называют орбиталью.
Орбитали бывают s p d f.
Материал этого урока всегда считался достаточно сложным и непонятным.
Последовательно, заглядывая в записи школьной тетради, выполняем тесты. Если что-то будет непонятно, напишите. До 23.00, вторника, буду на связи.
1. Уровни и подуровни здесь.
2.Электронные формулы атомов здесь.
3.Электронные формулы элементов ( 1,2 период) здесь
4.Электронные формулы элементов, интерактивный тест, здесь и здесь
Орбитали бывают s p d f.
Материал этого урока всегда считался достаточно сложным и непонятным.
Последовательно, заглядывая в записи школьной тетради, выполняем тесты. Если что-то будет непонятно, напишите. До 23.00, вторника, буду на связи.
1. Уровни и подуровни здесь.
2.Электронные формулы атомов здесь.
3.Электронные формулы элементов ( 1,2 период) здесь
4.Электронные формулы элементов, интерактивный тест, здесь и здесь
Зачет в 9- классах
13 апреля и 14 апреля в 9-х классах будет проводится зачет по теме
"Углерод и его соединения"
Зачет принимают:
2.Оксиды углерода.
"Углерод и его соединения"
Зачет принимают:
1.Аллотропия углерода.
Красова Настя, Ткачев Павел
2.Оксиды углерода.
Камышникова Света, Сальникова Женя
3.Карбонаты, гидрокарбонаты.
Кудрявцева Катя, Ромина Вероника
среда, 11 апреля 2012 г.
Глюкоза
Первый урок по углеводам.
Глюкоза, молекулярная и структурная формула.
Для установления структурной формулы молекулы глюкозы необходимо знать ее химические свойства.
Глюкоза вступает в реакцию "серебряного зеркала", значит она содержит функциональную группировку альдегидов.
Для глюкозы характерна реакция с гидроксидом меди (II), что говорит о ее принадлежности к многоатомным спиртам.
Глюкоза, молекулярная и структурная формула.
Для установления структурной формулы молекулы глюкозы необходимо знать ее химические свойства.
Глюкоза вступает в реакцию "серебряного зеркала", значит она содержит функциональную группировку альдегидов.
Для глюкозы характерна реакция с гидроксидом меди (II), что говорит о ее принадлежности к многоатомным спиртам.
Глюкоза - это альдегидоспирт.
Циклические формы глюкозы здесь
Строение электронных оболочек
Самые значимые выводы, которые мы сделали на уроке:
- N периода - это количество энергетических уровней,
- N группы - это количество электронов на последнем уровне у элементов главных подгрупп,
- завершенный уровень содержит 8 электронов на последнем уровне у элементов главных подгрупп (иск.1 уровень),
- незавершенный уровень - от 1 до 7 электронов на последнем уровне у элементов главных подгрупп.
вторник, 10 апреля 2012 г.
Строение атома
Информация о строении атома
1.Опыты Д.Томпсона здесь
2.Опыты Э.Резерфорда здесь
3.Основные характеристики элементарных частниц здесь (выполнить интерактивный тест)
4.Укажите количество протонов, электронов, нейтронов, тест здесь
5.Изотопы атома углерода, задание здесь
6.Относительный расчет атомной массы элемента здесь ( на примере атома хлора)
Задания в форме теста по этой теме не даю, вся информация была на уроке, ДЗ выполняем в классной тетради.
1.Опыты Д.Томпсона здесь
2.Опыты Э.Резерфорда здесь
3.Основные характеристики элементарных частниц здесь (выполнить интерактивный тест)
4.Укажите количество протонов, электронов, нейтронов, тест здесь
5.Изотопы атома углерода, задание здесь
6.Относительный расчет атомной массы элемента здесь ( на примере атома хлора)
Задания в форме теста по этой теме не даю, вся информация была на уроке, ДЗ выполняем в классной тетради.
суббота, 7 апреля 2012 г.
Периодическая система химических элементов
Ребята, мы начали изучение очень важной темы "Периодическая система химических элементов". Чтобы лучше подготовиться к уроку, просмотрите и выполните интерактивные тесты:
- положение элемента в периодической системе здесь
- структурные части периодической системы, ПЕРИОДЫ здесь
- структурные части периодической системы, ГРУППЫ здесь
- выполните задание по распределению химических элементов по главным и побочным подгруппам, задание здесь
Если вы все внимательно изучили и просмотрели интерактивные тесты, то легко справитесь с моим тестом. Комментарии, как всегда , желательны.
Доступ к документу будет предоставлен в понедельник в 21.00.
Успехов!
Доступ к документу будет предоставлен в понедельник в 21.00.
Успехов!
четверг, 5 апреля 2012 г.
Соли угольной кислоты
Соли угольной кислоты, карбонаты и гидрокарбонаты.
Все карбонаты- твердые кристаллические вещества. Большинство из них практически нерастворимы в воде. Гидрокарбонаты сравнительно хорошо растворимы в воде. Наиболее интересными соединениями являются карбонат и гидрокарбонат кальция.
При длительном пропускании оксида углерода (IV) через раствор известкового молока - Са(ОН)2 сначала выпадает осадок белого цвета СаСО3, потом раствор становится прозрачным, так как образуется гидрокарбонат кальция..
Если полученный прозрачный раствор нагреть, то снова происходит помутнение.
СаСО3 + СО2 + Н2О = Са(НСО3)2
Подобные процессы протекают в природе, образуя удивительные пещеры, сталактиты, сталагмиты.
Сталакти́ты (греч. Σταλακτίτης — натёкший по капле) — хемогенные отложения в карстовых пещерах в виде образований, свешивающихся с потолка (сосульки, соломинки, гребёнки, бахромы и т. п.). Термины «сталактит» и «сталагмит» введены в литературу в 1655 г. датским натуралистомОле Вормом.

Все карбонаты- твердые кристаллические вещества. Большинство из них практически нерастворимы в воде. Гидрокарбонаты сравнительно хорошо растворимы в воде. Наиболее интересными соединениями являются карбонат и гидрокарбонат кальция.
При длительном пропускании оксида углерода (IV) через раствор известкового молока - Са(ОН)2 сначала выпадает осадок белого цвета СаСО3, потом раствор становится прозрачным, так как образуется гидрокарбонат кальция..
Если полученный прозрачный раствор нагреть, то снова происходит помутнение.
СаСО3 + СО2 + Н2О = Са(НСО3)2
Подобные процессы протекают в природе, образуя удивительные пещеры, сталактиты, сталагмиты.
Сталакти́ты (греч. Σταλακτίτης — натёкший по капле) — хемогенные отложения в карстовых пещерах в виде образований, свешивающихся с потолка (сосульки, соломинки, гребёнки, бахромы и т. п.). Термины «сталактит» и «сталагмит» введены в литературу в 1655 г. датским натуралистомОле Вормом.
В узком смысле сталактитами называют кальцитовые натёчно-капельные образования, имеющие форму сосульки с внутренним питающим каналом. В широком смысле это могут быть как висящие на потолке натёчные образования разнообразных форм, так и образования в форме сосульки, но имеющие абсолютно иной механизм возникновения (ледяные, глиняные, гипсовые, соляные, лавовые сталактиты). В поперечном разрезе их строение сходно с градинами. При выпадении снега с дождём часто образуются тоже сосульки, только снежные.
Вода, проникающая в пещеру, растворяет известняк в химической реакции:
- CaCO3 + H2O + CO2 <=> Ca2+ + 2 HCO3-
При определённых условиях (разница в парциальном давлении углекислого газа в растворе и воздухе) реакция идёт в обратную сторону, и происходит отложение карбоната кальция — растут сталактиты. Происходит это весьма медленно, характерное время — десятки, сотни лет. Длина сталактитов в отдельных случаях достигает нескольких метров.

Подписаться на:
Комментарии (Atom)










































